
【题目】镁一空气电池是一种能被水激活的一次性储备电池,原理如图所示。下列说法错误的是( )

A.放电时,外电路电子由多孔碳材料电极流向镁电极
B.放电时,正极的电极反应式为O2+4e-+2H2O=4OH-
C.理论上,外电路中流过2mol电子时,负极质量增加34g
D.电池反应产物Mg(OH)2经过灼烧与还原可制成镁从而循环利用
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.我国自主研发的“龙芯1号”CPU芯片与光导纤维是同种材料
B.普通玻璃是以纯碱、石灰石和石英砂为原料制备的
C.水晶项链和餐桌上的瓷盘都是硅酸盐制品
D.粗硅制备单晶硅不涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.Na与水反应:Na+2H2O=Na++2OH-+H2↑
B.用NaOH溶液吸收NO2:2NO2+Na++2OH-=NaNO3+NO2-+H2O
C.用MnO2和浓盐酸反应制备Cl2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa时,有以下能量转化图,下列说法不正确的是( )
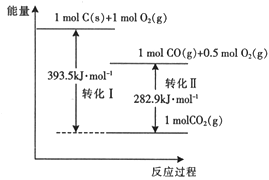
A. 转化Ⅱ的热化学方程式2CO(g)+O2(g)=2CO2(g) △H=-282.9 kJ·mol-1
B. 相同条件下,1mol C(s )和0.5 mol O2(g)总能量高于1mol CO(g)的能量
C. 由C→CO 的热化学方程式2C(s)+O2(g)=2CO(g) △H=-221.2 kJ·mol-1
D. CO2(g)分解为C(s)和O2(g)是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.按要求写出下列反应的方程式
(1)铝与足量氢氧化钠溶液反应的离子方程式 ______
(2)过氧化钠与水反应的化学方程式 ____
(3) 实验室制氢氧化铝的离子方程式 ________
Ⅱ. 请补充完整,配平方程式并用单线桥标出电子转移方向和数目
(1)KI+KIO3+H2SO4═I2+K2SO4+H2O:________________________
(2)MnO4-+NO2-+ ═Mn2++NO3-+H2O:_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol/L的HR溶液中逐滴加入0.1mol/L的氨水,所得溶液pH及导电能力变化如图。下列分析正确的是( )
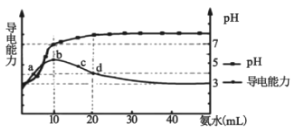
A.溶液中的阳离子浓度总和最大的是d点
B.常温下,HR的电离平衡常数数量级为10-8
C.b点和d点溶液中,水的电离程度不相等
D.d点的溶液中,微粒浓度关系:c(R-)+2c(HR)=c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2SO3是一种白色粉末,工业上可用作还原剂、防腐剂等。某化学小组探究不同pH的Na2SO3溶液与同浓度AgNO3溶液反应的产物,进行如下实验。
I.(1)配制500mL一定浓度的Na2SO3溶液
①溶解:准确称取一定质量的Na2SO3晶体,用煮沸的蒸馏水溶解。蒸馏水需煮沸的原因是___。
②移液:将上述溶解后的Na2SO3溶液在烧杯中冷却后转入仪器A中,则仪器A为_,同时洗涤___(填仪器名称)2~3次,将洗涤液一并转入仪器A中;
③定容:加水至刻度线1~2cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀。
Ⅱ.探究不同pH的Na2SO3溶液与pH=4的AgNO3溶液反应的产物
查阅资料:i.Ag2SO3为白色固体,不溶于水,溶于过量Na2SO3溶液
ii.Ag2O,棕黑色固体,不溶于水,可与浓氨水反应
(2)将pH=8的Na2SO3溶液滴人pH=4的AgNO3溶液中,至产生白色沉淀。
假设一:该白色沉淀为Ag2SO3
假设二:该白色沉淀为Ag2SO4
假设三:该白色沉淀为Ag2SO3和Ag2SO4的混合物
①写出假设一的离子方程式__;
②提出假设二的可能依据是___;
③验证假设三是否成立的实验操作是__。
(3)将pH=4的AgNO3溶液逐滴滴人足量的pH=11的Na2SO3溶液中,开始产生白色沉淀A,然后变成棕黑色物质。为了研究白色固体A的成分,取棕黑色固体进行如下实验:

①已知反应(b)的化学方程式为Ag(NH3)2OH+3HCl=AgCl↓+2NH4Cl+H2O,则反应(a)的化学方程式为___;
②生成白色沉淀A的反应为非氧化还原反应,则A的主要成分是__(写化学式)。
(4)由上述实验可知,盐溶液间的反应存在多样性。经验证,(2)中实验假设一成立,则(3)中实验的产物不同于(2)实验的条件是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应A(g)![]() 2B(g) H>0,在温度为T1和T2时,平衡体系中B的体积分数随压强变化的曲线如图所示。
2B(g) H>0,在温度为T1和T2时,平衡体系中B的体积分数随压强变化的曲线如图所示。

(1)根据曲线图,下列说法不正确的是___。
A.a、c两点的反应速率:c>a
B.b、c两点A气体的转化率相等
C.由状态b到状态a,可以通过加热的方法
D.由状态b到状态c,可以通过加压的方法
(2)若上述反应在定容密闭容器中进行,达到平衡状态的标志是___。
A.单位时间内生成nmolA的同时分解2nmolB B.两种气体的体积分数不再改变
C.混合气体的密度不再发生变化 D.混合气体的质量不再发生变化
(3)若上述反应达平衡时,B气体的平衡浓度为0.1mol·L-1,通过减小体积来增大体系的压强(温度保持不变),重新达平衡后,B气体的平衡浓度___0.1mol·L-1(填“大于”、“小于”或“等于”)。
(4)在100℃时,将0.40mol的B气体充入2L密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如表的数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(B)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(A)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
上表中n3___n4(填“大于”、“小于”或“等于”),反应A(g)![]() 2B(g)在100℃时的平衡常数K的值为___,升高温度后,反应2B(g)
2B(g)在100℃时的平衡常数K的值为___,升高温度后,反应2B(g)![]() A(g)的平衡常数K的值___(填“增大”、“减小”或“不变”)。
A(g)的平衡常数K的值___(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把10.2g镁铝合金的粉末放入过量的盐酸中,得到11.2L H2(标准状况下).试计算(写出计算过程):
(1)该合金中铝的质量分数;
(2)该合金中铝和镁的物质的量之比.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com