
【题目】下列指定反应的离子方程式正确的是( )
A.Na与水反应:Na+2H2O=Na++2OH-+H2↑
B.用NaOH溶液吸收NO2:2NO2+Na++2OH-=NaNO3+NO2-+H2O
C.用MnO2和浓盐酸反应制备Cl2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如下图所示。下列说法正确的是( )

A.HA的酸性比HB的酸性弱
B.a点溶液的导电性比c点溶液的导电性弱
C.若两溶液无限稀释,则它们的c(H+)相等
D.对a、b两点溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4-环己二醇可通过下列路线合成:
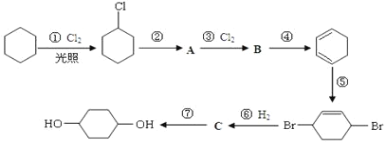
(1)写出反应①、④、⑦的化学方程式:①____________;④____________;⑦____________。
(2)②的反应类型是____________,上述七个反应中属于加成反应的有(填序号)____________。
(3)反应⑤中可能产生一定量的副产物,其可能的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型绿色、高效的水处理剂,对病毒的去除率可达99.95%。已知K2FeO4在低于常温的碱性环境中稳定,酸性条件下,其氧化性强于KMnO4、Cl2等。某小组设计制备K2FeO4并测定其纯度的实验步骤如下:
I.制备次氯酸钾。在搅拌和冰水浴条件下,将Cl2通入浓KOH溶液,同时补加一定量KOH,产生了大量白色沉淀,抽滤后得到浓KClO滤液。
II.制备高铁酸钾(装置如图)
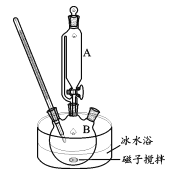
碱性条件下,向如图装置加入上述浓KClO 溶液与冰水浴磁子搅拌Fe(NO3)3;饱和溶液,反应一段时间,得到紫黑色溶液和大量白色沉淀,抽滤分离,用冰盐浴进一步冷却滤液得到K2FeO4粗品。
III.测定高铁酸钾样品的纯度。取0.300g上述步骤制备的K2FeO4样品于锥形瓶,在强碱性溶液中,用过量CrO2-与FeO42-反应生成 CrO42-和Fe(OH)3。稀硫酸酸化后加入指示剂,以0.150mol/L(NH)2Fe(SO4)2标准溶液滴定 Cr(VI)至 Cr3+,终点消耗 20.0mL。
(1)步骤I制备次氯酸钾的化学方程式为_____;“补加一定量KOH”的目的除了与过量Cl2继续反应生成更多KClO外,还在步骤II中起到___________的作用。
(2)根据 K2FeO4理论合成产率与合成条件响应曲面投影图(见图,虚线上的数据表示K2FeO4的理论合成产率),步骤II中控制的条件应是:温度______ (序号,下同),反应时间_____________。
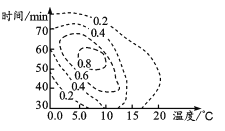
a.0.0~5.0℃ b.5.0~10℃ c.10~15℃ d.40~50 min e.50~60 min f.60~70 min
(3)步骤II中,为了避免副产物K3FeO4的产生,Fe(NO3)3饱和溶液应放在仪器A中,A的名称是________;写出实验刚开始时生成FeO42-的离子方程式________。
(4)根据步骤皿I的测定数据,计算高铁酸钾样品纯度为_____(保留3位有效数字)。
(5)为探究酸性条件下FeO42-氧化性强弱,甲同学取步骤II所得K2FeO4粗品加入到少量盐酸中,观察到产生黄绿色气体,经检验气体为Cl2。该现象能否证明“酸性条件下FeO42-氧化性强于Cl2”,并说明理由_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以工业钴渣为原料制取CoSO4溶液和ZnSO4·7H2O晶体,其实验流程如下:
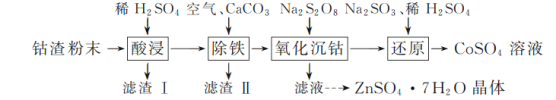
已知:①“酸浸”所得溶液中主要含CoSO4、ZnSO4,另含少量FeSO4、NiSO4。②金属活动性:Ni介于Fe、Cu之间。③下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度1 mol·L-1计算,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-):
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Co2+ | 7.6 | 9.4 |
Zn2+ | 5.9 | 8.9 |
(1)“酸浸”时所加稀硫酸不宜过量太多的原因是________。
(2)“除铁”时,向溶液中持续鼓入空气的作用是________。
(3)流程中需将滤渣Ⅰ、滤渣Ⅱ的洗涤液与“除铁”后所得滤液合并,目的是________。
(4)写出“还原”过程中Na2SO3、稀H2SO4与Co(OH)3反应的离子方程式:________。
(5)实验所得CoSO4溶液可用于制备CoCO3,制备时CoSO4饱和溶液与Na2CO3饱和溶液的混合方式为________。
(6)请结合如图硫酸锌晶体的溶解度曲线,设计从“氧化沉钴”后的滤液(含ZnSO4、Na2SO4、NiSO4等)中获取ZnSO4·7H2O的实验方案:取适量滤液,____________________________,过滤,用少量冰水洗涤,低温干燥得ZnSO4·7H2O晶体。(实验中须使用的试剂有:Zn粉、1.0 mol·L-1 NaOH、1.0 mol·L-1 H2SO4)
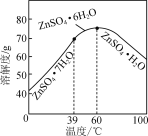
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于A2(g)+3B2(g)![]() 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
A. v(A2)=0.8 mol·L-1·s-1 B. v(A2)=30 mol·L-1·min-1
C. v(AB3)=1.0 mol·L-1·s-1 D. v(B2)=1.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气中的NO经过O3预处理,再用CaSO3悬浊液吸收去除。预处理时发生反应:NO(g)+O3(g)![]() NO2(g)+O2(g)。测得:v正=k正c(NO)·c(O3),v逆=k逆c(NO2)·c(O2),k正、k逆为速率常数,受温度影响。向容积均为2L的甲、乙两个密闭容器中充入一定量的NO和O3,测得NO的体积分数随时间的变化如图所示。下列说法正确的是( )
NO2(g)+O2(g)。测得:v正=k正c(NO)·c(O3),v逆=k逆c(NO2)·c(O2),k正、k逆为速率常数,受温度影响。向容积均为2L的甲、乙两个密闭容器中充入一定量的NO和O3,测得NO的体积分数随时间的变化如图所示。下列说法正确的是( )
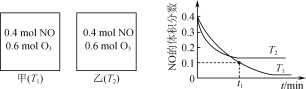
A.高温有利于提高容器中NO的平衡转化率
B.T1时,反应在t1min内的平均速率v(O2)=![]() mol·L-1·min-1
mol·L-1·min-1
C.T1时,NO(g)+O3(g)![]() NO2(g)+O2(g)的k正>3k逆
NO2(g)+O2(g)的k正>3k逆
D.T2时,向2L密闭容器中充入0.6molNO、0.4molO3,到达平衡时c(NO2)小于乙容器中平衡时c(NO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁一空气电池是一种能被水激活的一次性储备电池,原理如图所示。下列说法错误的是( )

A.放电时,外电路电子由多孔碳材料电极流向镁电极
B.放电时,正极的电极反应式为O2+4e-+2H2O=4OH-
C.理论上,外电路中流过2mol电子时,负极质量增加34g
D.电池反应产物Mg(OH)2经过灼烧与还原可制成镁从而循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】降冰片二烯类化合物是一类太阳能储能材料,降冰片二烯在紫外线照射下可以发生下列转化。下列说法错误的是

A.四环烷的一氯代物超过三种(不考虑立体异构)
B.降冰片二烯能使酸性高锰酸钾溶液褪色
C.降冰片二烯与四环烷互为同分异构体
D.降冰片二烯分子中位于同一平面的碳原子不超过4个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com