
【题目】实验室以工业钴渣为原料制取CoSO4溶液和ZnSO4·7H2O晶体,其实验流程如下:
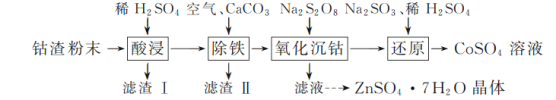
已知:①“酸浸”所得溶液中主要含CoSO4、ZnSO4,另含少量FeSO4、NiSO4。②金属活动性:Ni介于Fe、Cu之间。③下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度1 mol·L-1计算,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-):
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Co2+ | 7.6 | 9.4 |
Zn2+ | 5.9 | 8.9 |
(1)“酸浸”时所加稀硫酸不宜过量太多的原因是________。
(2)“除铁”时,向溶液中持续鼓入空气的作用是________。
(3)流程中需将滤渣Ⅰ、滤渣Ⅱ的洗涤液与“除铁”后所得滤液合并,目的是________。
(4)写出“还原”过程中Na2SO3、稀H2SO4与Co(OH)3反应的离子方程式:________。
(5)实验所得CoSO4溶液可用于制备CoCO3,制备时CoSO4饱和溶液与Na2CO3饱和溶液的混合方式为________。
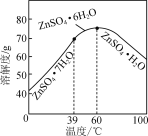
(6)请结合如图硫酸锌晶体的溶解度曲线,设计从“氧化沉钴”后的滤液(含ZnSO4、Na2SO4、NiSO4等)中获取ZnSO4·7H2O的实验方案:取适量滤液,____________________________,过滤,用少量冰水洗涤,低温干燥得ZnSO4·7H2O晶体。(实验中须使用的试剂有:Zn粉、1.0 mol·L-1 NaOH、1.0 mol·L-1 H2SO4)
【答案】避免除铁时消耗过多的CaCO3 将Fe2+氧化,搅拌溶液,加快反应速率 为提高Co、Zn的回收率 SO![]() +2Co(OH)3+4H+=2Co2++SO
+2Co(OH)3+4H+=2Co2++SO![]() +5H2O 将Na2CO3饱和溶液缓慢滴加到CoSO4饱和溶液中,并不断搅拌 向其中加入过量的Zn粉后过滤,向所得滤液中滴加1.0 mol·L-1 NaOH,控制pH约为10(8.9~11)使Zn2+完全沉淀,所得沉淀洗净后用1.0 mol·L-1 H2SO4完全溶解,将所得溶液蒸发浓缩至有晶膜出现,冷却至0 ℃(39 ℃以下)结晶
+5H2O 将Na2CO3饱和溶液缓慢滴加到CoSO4饱和溶液中,并不断搅拌 向其中加入过量的Zn粉后过滤,向所得滤液中滴加1.0 mol·L-1 NaOH,控制pH约为10(8.9~11)使Zn2+完全沉淀,所得沉淀洗净后用1.0 mol·L-1 H2SO4完全溶解,将所得溶液蒸发浓缩至有晶膜出现,冷却至0 ℃(39 ℃以下)结晶
【解析】
钴渣中加稀硫酸将可溶于酸的物质转变成硫酸盐,难溶于硫酸的进入滤渣1,得到溶液中主要含CoSO4、ZnSO4,另含少量FeSO4、NiSO4,滤液中通入氧气亚铁离子氧化成三价铁离子,加碳酸钙中和硫酸调节pH值将铁沉淀除去,过滤后滤液中加Na2S2O8,氧化沉淀钴,过滤得钴的沉淀物加亚硫酸钠和稀硫酸还原的得到硫酸钴,滤液中主要是硫酸锌,除去杂质后经过蒸发浓缩、冷却结晶、过滤得到ZnSO4·7H2O晶体,据此分析解答。
(1)“酸浸”时所加稀硫酸不宜过量太多,因后续步骤中要加碳酸钙调节溶液pH值,硫酸过多会增加碳酸钙的用量,故答案为:避免除铁时消耗过多的CaCO3;
(2)因为原溶液中的铁是二价铁,二价铁直接沉淀时需要调控的pH较大且会使其他金属阳离子沉淀,因此以溶解度更小的氢氧化铁形式除铁更合理,需通入空气将亚铁离子氧化,同时持续鼓入空气可以起到搅拌溶液加快速率的作用,故答案为:将Fe2+氧化,搅拌溶液,加快反应速率;
(3)流程中需将滤渣Ⅰ、滤渣Ⅱ的洗涤液与“除铁”后所得滤液合并可以减少钴和锌的损失,提高两者的回收率,故答案为:为提高Co、Zn的回收率;
(4)还原”过程中Na2SO3、稀H2SO4与Co(OH)3反应产物为硫酸钴和硫酸钠,可得方程式为:SO![]() +2Co(OH)3+4H+=2Co2++SO
+2Co(OH)3+4H+=2Co2++SO![]() +5H2O,故答案为:SO
+5H2O,故答案为:SO![]() +2Co(OH)3+4H+=2Co2++SO
+2Co(OH)3+4H+=2Co2++SO![]() +5H2O;
+5H2O;
(5)实验所得CoSO4溶液可用于制备CoCO3,制备时CoSO4饱和溶液与Na2CO3饱和溶液的混合方式为将Na2CO3饱和溶液缓慢滴加到CoSO4饱和溶液中,并不断搅拌,故答案为:将Na2CO3饱和溶液缓慢滴加到CoSO4饱和溶液中,并不断搅拌;
(6)氧化沉钴”后的滤液(含ZnSO4、Na2SO4、NiSO4等)中有杂质直接结晶得不到纯净的晶体,因此要先加足量的锌粉置换出镍,之后加氢氧化钠调节溶液pH将锌转变成沉淀后过滤的到氢氧化锌固体,再将固体溶于硫酸,蒸发浓缩再冷却至39 ℃以下结晶,具体操作:向其中加入过量的Zn粉后过滤,向所得滤液中滴加1.0 mol·L-1 NaOH,控制pH约为10(8.9~11)使Zn2+完全沉淀,所得沉淀洗净后用1.0 mol·L-1 H2SO4完全溶解,将所得溶液蒸发浓缩至有晶膜出现,冷却至0 ℃(39 ℃以下)结晶,故答案为:向其中加入过量的Zn粉后过滤,向所得滤液中滴加1.0 mol·L-1 NaOH,控制pH约为10(8.9~11)使Zn2+完全沉淀,所得沉淀洗净后用1.0 mol·L-1 H2SO4完全溶解,将所得溶液蒸发浓缩至有晶膜出现,冷却至0 ℃(39 ℃以下)结晶。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】可逆反应:A(g)+B(g) ![]() C(s)+2D(g)的ΔH>0,下图所示为正逆反应速率(v)与时间(t)的关系,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤移走C,符合图示的条件是( )。
C(s)+2D(g)的ΔH>0,下图所示为正逆反应速率(v)与时间(t)的关系,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤移走C,符合图示的条件是( )。
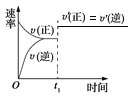
A. ②③B. ①②C. ③④D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)请根据官能团的不同对下列有机物进行分类。
①CH3CH2OH ②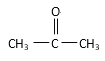 ③CH3CH2Br ④CH3COOCH2CH3 ⑤
③CH3CH2Br ④CH3COOCH2CH3 ⑤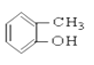 ⑥
⑥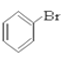 ⑦CH3CHO ⑧HCOOH ⑨
⑦CH3CHO ⑧HCOOH ⑨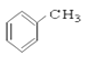 ⑩
⑩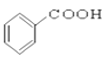
(1)芳香烃:____________
(2)卤代烃:______________
(3)醇:__________
(4)酚:______________
(5)醛:______________
(6)酮:_______________
(7)羧酸:___________________
(8)酯:______________________
(Ⅱ)![]() 的分子式为________________,
的分子式为________________,![]() 中含有的官能团的名称为________________ 。
中含有的官能团的名称为________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如下装置制取氯化铁粉末,已知氯化铁粉末很容易吸水生成结晶化合物FeCl3+6H2O = FeCl3·6H2O
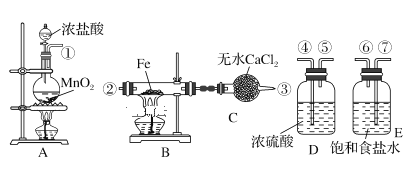
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序,各接口序号间用“—”连接):①—_____。
(2)烧瓶A中反应的离子方程式为________,其中,氧化剂是________(填物质名称)。
(3)B中反应的化学方程式是_____________。
(4)装置C的作用是_______________。
(5)A、B中的酒精灯应先点燃____处(填“A”或“B”)的酒精灯,理由是__________。
(6)小明同学认为这套实验装置不完整,还须补充________装置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯酚是一种很有价值的化工原料,年产量可达几百万吨。苯酚可合成著名的解热镇痛药——阿司匹林,也可合成聚碳酸酯,其合成路线如下:

(1)阿司匹林分子中的含氧官能团名称为_______;G的化学名称是____。
(2)E为饱和一元酮,其结构简式为________;H和K合成聚碳酸酯的反应类型是_____。
(3)鉴别G和阿司匹林的一种显色试剂为___________
(4)已知K的相对分子质量为99,其分子式为____________
(5)写出阿司匹林与足量NaOH溶液反应的化学方程式_________
(6)写出能同时满足以下条件的阿司匹林的两种异构体的结构简式_______________
①苯环上只有两种一氯代物;②含有羧基;③水解产生酚。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.Na与水反应:Na+2H2O=Na++2OH-+H2↑
B.用NaOH溶液吸收NO2:2NO2+Na++2OH-=NaNO3+NO2-+H2O
C.用MnO2和浓盐酸反应制备Cl2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4、N2O4常用作火箭发射的推进剂。推进剂发生反应:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)。下列有关说法正确的是( )
A.反应每生成0.3 mol N2,转移电子的数目为1.6×6.02×1023
B.充有N2O4的密闭容器中存在:N2O4(g)![]() 2NO2(g),当c(N2O4)∶c(NO2)=1∶2时,该可逆反应到达限度
2NO2(g),当c(N2O4)∶c(NO2)=1∶2时,该可逆反应到达限度
C.碱性N2H4—空气燃料电池工作时,正极电极反应式为O2+2H2O+4e-=4OH-
D.N2H4的水溶液中存在:N2H4+H2O![]() N2H
N2H![]() +OH-,向稀溶液中加水稀释,
+OH-,向稀溶液中加水稀释, ![]() 的值变大
的值变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.按要求写出下列反应的方程式
(1)铝与足量氢氧化钠溶液反应的离子方程式 ______
(2)过氧化钠与水反应的化学方程式 ____
(3) 实验室制氢氧化铝的离子方程式 ________
Ⅱ. 请补充完整,配平方程式并用单线桥标出电子转移方向和数目
(1)KI+KIO3+H2SO4═I2+K2SO4+H2O:________________________
(2)MnO4-+NO2-+ ═Mn2++NO3-+H2O:_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如下图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为
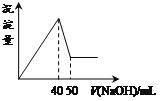
A.1:3B.1:2C.1:1D.2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com