
【题目】1,4-环己二醇可通过下列路线合成:
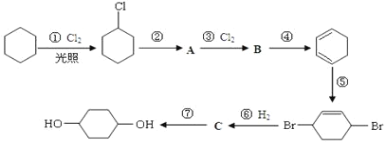
(1)写出反应①、④、⑦的化学方程式:①____________;④____________;⑦____________。
(2)②的反应类型是____________,上述七个反应中属于加成反应的有(填序号)____________。
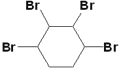
(3)反应⑤中可能产生一定量的副产物,其可能的结构简式为____________。
【答案】C6H12+Cl2→C6H11Cl+HCl ![]() +2NaOH
+2NaOH  +2NaCl+2H2O
+2NaCl+2H2O 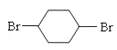 2NaOH
2NaOH +2NaBr 消去反应 ③⑤⑥
+2NaBr 消去反应 ③⑤⑥ 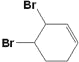 、
、
【解析】
苯和氯气在光照条件下发生取代生成氯苯,氯苯在醇强碱溶液中发生消去反应生成环己烯,环己烯和氯气发生加成反应生成1,2-二氯环己烷,1,2-二氯环己烷在醇强碱溶液中发生消去反应生成1,3-环己二烯,环己二烯与溴单质发生加成反应生成![]() ,
,![]() 与氢气发生加成反应生成
与氢气发生加成反应生成 ,
, 水解生成
水解生成![]() 。
。
⑴反应①是苯和氯气在光照条件下反应,化学方程式:![]() +Cl2
+Cl2![]()
![]() +HCl;
+HCl;
反应④是1,2-二氯环己烷在醇强碱溶液中发生消去反应生成1,3-环己二烯,其化学方程式![]() +2NaOH
+2NaOH  +2NaCl+2H2O;反应⑦是
+2NaCl+2H2O;反应⑦是 水解生成
水解生成![]() ,其化学方程式
,其化学方程式 +2NaOH
+2NaOH +2NaBr;
+2NaBr;
⑵七个反应类型分别是取代反应、消去反应、加成反应、消去反应、加成反应、加成反应、取代反应,故反应②为消去反应,属于加成反应的有③⑤⑥;
⑶反应发生加成反应,可能是1,2加成,也可能是1,2,3,4都加成,故答案为 、
、 。
。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】已知A转化为C和D分步进行:①A(g)![]() B(g)+2D(g)②B(g)
B(g)+2D(g)②B(g)![]() C(g)+D(g),其反应过程能量如图所示,下列说法正确的是( )
C(g)+D(g),其反应过程能量如图所示,下列说法正确的是( )
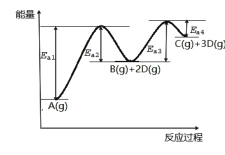
A.1molA(g)的能量低于1molB(g)的能量
B.B(g)![]() C(g)+D(g) ΔH=Ea4-Ea3
C(g)+D(g) ΔH=Ea4-Ea3
C.断裂1molA(g)化学键吸收的热量小于形成1molC(g)和3molD(g)化学键所放出的热量
D.反应过程中,由于Ea3<Ea1,反应②速率大于反应①,气体B很难大量积累
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用如图所示装置探究二氧化硫气体的性质。
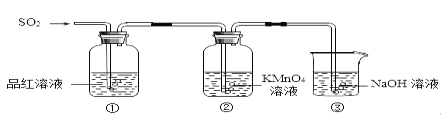
请回答:
(1)实验室用铜和浓硫酸共热制取二氧化硫,反应的化学方程式是_________。
(2)当观察到②中溶液颜色变浅时,①中的现象是_________。
(3)装置③的作用是________。
(4)①、②中的现象说明二氧化硫具有的性质是_________。
(5)③中涉及的化学反应方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.我国自主研发的“龙芯1号”CPU芯片与光导纤维是同种材料
B.普通玻璃是以纯碱、石灰石和石英砂为原料制备的
C.水晶项链和餐桌上的瓷盘都是硅酸盐制品
D.粗硅制备单晶硅不涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)请根据官能团的不同对下列有机物进行分类。
①CH3CH2OH ②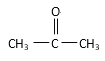 ③CH3CH2Br ④CH3COOCH2CH3 ⑤
③CH3CH2Br ④CH3COOCH2CH3 ⑤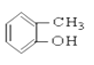 ⑥
⑥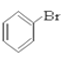 ⑦CH3CHO ⑧HCOOH ⑨
⑦CH3CHO ⑧HCOOH ⑨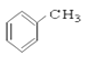 ⑩
⑩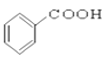
(1)芳香烃:____________
(2)卤代烃:______________
(3)醇:__________
(4)酚:______________
(5)醛:______________
(6)酮:_______________
(7)羧酸:___________________
(8)酯:______________________
(Ⅱ)![]() 的分子式为________________,
的分子式为________________,![]() 中含有的官能团的名称为________________ 。
中含有的官能团的名称为________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类法在化学物质及反应的学习中起着重要的作用。有以下物质:①液氯②磁性氧化铁③碱石灰④石油⑤氢氧化铁胶体⑥浓硫酸⑦黑火药⑧铜
(1)上述物质中属于混合物的是___________。
(2)石油可以通过分馏(多次蒸馏)得到煤油、汽油等产物,该变化属于___(填“物理变化”或“化学变化”)。
(3)简述浓硫酸稀释的操作_________________。
(4)氢氧化铁胶体和氢氧化铁沉淀的本质区别在于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如下装置制取氯化铁粉末,已知氯化铁粉末很容易吸水生成结晶化合物FeCl3+6H2O = FeCl3·6H2O
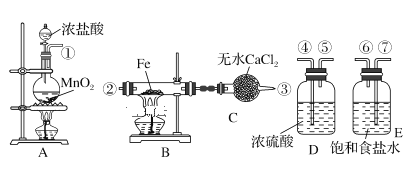
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序,各接口序号间用“—”连接):①—_____。
(2)烧瓶A中反应的离子方程式为________,其中,氧化剂是________(填物质名称)。
(3)B中反应的化学方程式是_____________。
(4)装置C的作用是_______________。
(5)A、B中的酒精灯应先点燃____处(填“A”或“B”)的酒精灯,理由是__________。
(6)小明同学认为这套实验装置不完整,还须补充________装置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.Na与水反应:Na+2H2O=Na++2OH-+H2↑
B.用NaOH溶液吸收NO2:2NO2+Na++2OH-=NaNO3+NO2-+H2O
C.用MnO2和浓盐酸反应制备Cl2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2SO3是一种白色粉末,工业上可用作还原剂、防腐剂等。某化学小组探究不同pH的Na2SO3溶液与同浓度AgNO3溶液反应的产物,进行如下实验。
I.(1)配制500mL一定浓度的Na2SO3溶液
①溶解:准确称取一定质量的Na2SO3晶体,用煮沸的蒸馏水溶解。蒸馏水需煮沸的原因是___。
②移液:将上述溶解后的Na2SO3溶液在烧杯中冷却后转入仪器A中,则仪器A为_,同时洗涤___(填仪器名称)2~3次,将洗涤液一并转入仪器A中;
③定容:加水至刻度线1~2cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀。
Ⅱ.探究不同pH的Na2SO3溶液与pH=4的AgNO3溶液反应的产物
查阅资料:i.Ag2SO3为白色固体,不溶于水,溶于过量Na2SO3溶液
ii.Ag2O,棕黑色固体,不溶于水,可与浓氨水反应
(2)将pH=8的Na2SO3溶液滴人pH=4的AgNO3溶液中,至产生白色沉淀。
假设一:该白色沉淀为Ag2SO3
假设二:该白色沉淀为Ag2SO4
假设三:该白色沉淀为Ag2SO3和Ag2SO4的混合物
①写出假设一的离子方程式__;
②提出假设二的可能依据是___;
③验证假设三是否成立的实验操作是__。
(3)将pH=4的AgNO3溶液逐滴滴人足量的pH=11的Na2SO3溶液中,开始产生白色沉淀A,然后变成棕黑色物质。为了研究白色固体A的成分,取棕黑色固体进行如下实验:

①已知反应(b)的化学方程式为Ag(NH3)2OH+3HCl=AgCl↓+2NH4Cl+H2O,则反应(a)的化学方程式为___;
②生成白色沉淀A的反应为非氧化还原反应,则A的主要成分是__(写化学式)。
(4)由上述实验可知,盐溶液间的反应存在多样性。经验证,(2)中实验假设一成立,则(3)中实验的产物不同于(2)实验的条件是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com