
【题目】分类法在化学物质及反应的学习中起着重要的作用。有以下物质:①液氯②磁性氧化铁③碱石灰④石油⑤氢氧化铁胶体⑥浓硫酸⑦黑火药⑧铜
(1)上述物质中属于混合物的是___________。
(2)石油可以通过分馏(多次蒸馏)得到煤油、汽油等产物,该变化属于___(填“物理变化”或“化学变化”)。
(3)简述浓硫酸稀释的操作_________________。
(4)氢氧化铁胶体和氢氧化铁沉淀的本质区别在于________。
【答案】③④⑤⑥⑦ 物理变化 将浓硫酸沿杯壁缓慢加入蒸馏水中,边加边用玻璃棒搅拌 分散质粒子直径大小不同
【解析】
根据物质的分类方法和胶体的性质进行判断。
(1)有以下物质:①液氯为纯净物,②磁性氧化铁为四氧化三铁,属于纯净物,③碱石灰为氢氧化钠和氧化钙的混合物,④石油属于混合物,⑤氢氧化铁胶体是分散系,属于混合物,⑥浓硫酸属于混合物,⑦黑火药属于混合物,⑧铜单质属于纯净物,所以
上述物质中属于混合物的是③④⑤⑥⑦;答案:③④⑤⑥⑦。
(2)分馏利用沸点不同分离混合物,石油可以通过分馏(多次蒸馏)得到煤油、汽油等产物,该变化属于物理变化;答案:物理变化。
(3)将浓硫酸沿烧杯壁缓慢加入蒸馏水中,边加边用玻璃棒搅拌,使产生的热量迅速扩散;答案:将浓硫酸沿烧杯壁缓慢加入蒸馏水中,边加边用玻璃棒搅拌。
(4)氢氧化铁胶体的粒子直径为10-9![]() 10-7m,氢氧化铁沉淀属于浊液,粒子直径为大于10-7m,所以氢氧化铁胶体和氢氧化铁沉淀的本质是分散质粒子直径大小不同;答案:氢氧化铁胶体和氢氧化铁沉淀的本质区别在于分散质粒子直径大小不同。
10-7m,氢氧化铁沉淀属于浊液,粒子直径为大于10-7m,所以氢氧化铁胶体和氢氧化铁沉淀的本质是分散质粒子直径大小不同;答案:氢氧化铁胶体和氢氧化铁沉淀的本质区别在于分散质粒子直径大小不同。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某固体X可能含有Na2O2、Fe2O3、Al2O3、SiO2、K2SO4、Na2SO3、NH4NO3、MgCl2中的一种或几种物质,进行如下实验以确定其组成:
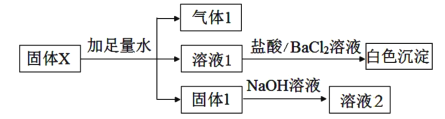
下列说法不正确的是( )
A.溶液1中不可能含有Cl-
B.气体1可能是二种气体的混合物
C.固体1可能是二种固体的混合物
D.固体X中,K2SO4和Na2SO3两种物质至少含一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。请根据以上信息完成下列各题:
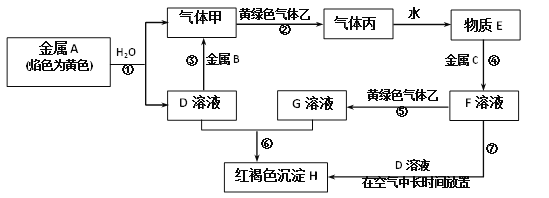
(1)写出下列物质的化学式:B_______、丙_______。
(2)写出黄绿色气体乙的一种用途_______,反应过程⑦可能观察到的实验现象是________。
(3)写出反应⑦中涉及的化学反应方程式:_______、________。
(4)写出反应⑤的离子方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
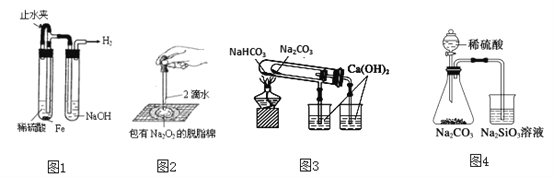
A. 图1:制备并观察氢氧化亚铁
B. 图2:证明过氧化钠与水反应放热
C. 图3:验证NaHCO3和Na2CO3的热稳定性
D. 图4:验证酸性强弱H2SO4>H2CO3>H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4-环己二醇可通过下列路线合成:
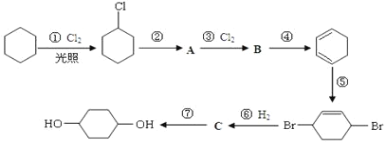
(1)写出反应①、④、⑦的化学方程式:①____________;④____________;⑦____________。
(2)②的反应类型是____________,上述七个反应中属于加成反应的有(填序号)____________。
(3)反应⑤中可能产生一定量的副产物,其可能的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案合理的是________
A.配制银氨溶液:在一定量![]() 溶液中,滴加氨水至沉淀恰好溶解
溶液中,滴加氨水至沉淀恰好溶解
B.检验RX中的卤素原子,把RX与烧碱水溶液混合加热后,将溶液冷却再加入硝酸银溶液
C.无水乙醇和浓硫酸共热至170℃,将制得的气体通入酸性高锰酸钾溶液,可检验制得的气体是否为乙烯
D.实验室制取乙烯时,必须将温度计的水银球插入反应液中,测定反应液的温度
E.乙烷中混有乙烯,通过氢气在一定条件下反应,使乙烯转化为乙烷
F.用氨水清洗做过银镜反应的试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型绿色、高效的水处理剂,对病毒的去除率可达99.95%。已知K2FeO4在低于常温的碱性环境中稳定,酸性条件下,其氧化性强于KMnO4、Cl2等。某小组设计制备K2FeO4并测定其纯度的实验步骤如下:
I.制备次氯酸钾。在搅拌和冰水浴条件下,将Cl2通入浓KOH溶液,同时补加一定量KOH,产生了大量白色沉淀,抽滤后得到浓KClO滤液。
II.制备高铁酸钾(装置如图)
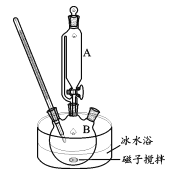
碱性条件下,向如图装置加入上述浓KClO 溶液与冰水浴磁子搅拌Fe(NO3)3;饱和溶液,反应一段时间,得到紫黑色溶液和大量白色沉淀,抽滤分离,用冰盐浴进一步冷却滤液得到K2FeO4粗品。
III.测定高铁酸钾样品的纯度。取0.300g上述步骤制备的K2FeO4样品于锥形瓶,在强碱性溶液中,用过量CrO2-与FeO42-反应生成 CrO42-和Fe(OH)3。稀硫酸酸化后加入指示剂,以0.150mol/L(NH)2Fe(SO4)2标准溶液滴定 Cr(VI)至 Cr3+,终点消耗 20.0mL。
(1)步骤I制备次氯酸钾的化学方程式为_____;“补加一定量KOH”的目的除了与过量Cl2继续反应生成更多KClO外,还在步骤II中起到___________的作用。
(2)根据 K2FeO4理论合成产率与合成条件响应曲面投影图(见图,虚线上的数据表示K2FeO4的理论合成产率),步骤II中控制的条件应是:温度______ (序号,下同),反应时间_____________。
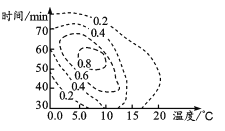
a.0.0~5.0℃ b.5.0~10℃ c.10~15℃ d.40~50 min e.50~60 min f.60~70 min
(3)步骤II中,为了避免副产物K3FeO4的产生,Fe(NO3)3饱和溶液应放在仪器A中,A的名称是________;写出实验刚开始时生成FeO42-的离子方程式________。
(4)根据步骤皿I的测定数据,计算高铁酸钾样品纯度为_____(保留3位有效数字)。
(5)为探究酸性条件下FeO42-氧化性强弱,甲同学取步骤II所得K2FeO4粗品加入到少量盐酸中,观察到产生黄绿色气体,经检验气体为Cl2。该现象能否证明“酸性条件下FeO42-氧化性强于Cl2”,并说明理由_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于A2(g)+3B2(g)![]() 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
A. v(A2)=0.8 mol·L-1·s-1 B. v(A2)=30 mol·L-1·min-1
C. v(AB3)=1.0 mol·L-1·s-1 D. v(B2)=1.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,可逆反应:A2(g)+B2(g)![]() xC(g)符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是
xC(g)符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是

A.P3<P4,Y轴表示A2的转化率
B.P3>P4,Y轴表示A2的浓度
C.P3>P4,Y轴表示混合气体的密度
D.P3>P4,Y轴表示混合气体的平均摩尔质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com