
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.18g氨基(-ND2)中含有的电子数为10NA
B.56gFe与1molCl2充分反应后转移电子的数目为3NA
C.向密闭容器中加入2molNO和1molO2,充分反应后容器中产物分子的数目为2NA
D.向100mL0.1mol/LNH4Cl溶液中通入NH3至溶液为中性,其中NH4+的数目为0.01NA
【答案】D
【解析】
A.18g氨基(-ND2)的物质的量为1mol,含有的电子数为9NA,故A错误;
B.56gFe的物质的量为1mol,与1molCl2充分反应生成![]() molFeCl3,则转移电子的数目为2NA,故B错误;
molFeCl3,则转移电子的数目为2NA,故B错误;
C.2molNO和1molO2完全反应生成2molNO2,但生成的NO2中存在平衡:2NO2![]() N2O4,导致分子个数减少,故容器中产物分子的数目小于2NA个,故C错误;
N2O4,导致分子个数减少,故容器中产物分子的数目小于2NA个,故C错误;
D.向100mL0.1mol/LNH4Cl溶液中通入NH3至溶液为中性,根据电荷守恒可知溶液中c(Cl-)=c(NH4+),则溶液中NH4+的数目为0.1mol/L×0.1L×NAmol-1= 0.01NA,故D正确;
故答案为D。


科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol/L的HR溶液中逐滴加入0.1mol/L的氨水,所得溶液pH及导电能力变化如图。下列分析正确的是( )
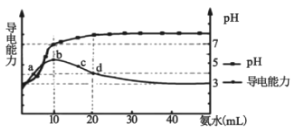
A.溶液中的阳离子浓度总和最大的是d点
B.常温下,HR的电离平衡常数数量级为10-8
C.b点和d点溶液中,水的电离程度不相等
D.d点的溶液中,微粒浓度关系:c(R-)+2c(HR)=c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验兴趣小组设计如下微型实验装置,a、b为直流电源的两极。实验时,若断开K1,闭合K2,两极均有气泡产生,下列有关描述正确的是( )
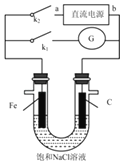
A.断开K1闭合K2时,总反应的离子方程式为:2H++2Cl﹣![]() H2↑+Cl2↑
H2↑+Cl2↑
B.断开K1闭合K2时,电子沿“a→Fe→电解质溶液→C→b”的路径流动
C.断开K2闭合K1时,此时发生的反应类似铁的吸氧腐蚀
D.断开K2闭合K1时,Fe电极被保护,此法称为牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液中可能存在Na+、Al3+、Fe2+、NH4+、NO3-、CO32-、SO42-中的几种离子,且存在的各离子具有相同的物质的量,某同学对该溶液进行如下实验:
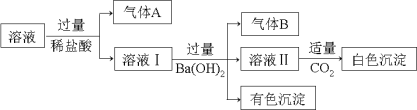
下列判断正确的是
A.气体A一定是CO2,气体B一定是NH3
B.白色沉淀不可能是Al(OH)3
C.溶液中一定存在Al3+、Fe2+、NO3-、NH4+
D.溶液中一定不存在大量Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把10.2g镁铝合金的粉末放入过量的盐酸中,得到11.2L H2(标准状况下).试计算(写出计算过程):
(1)该合金中铝的质量分数;
(2)该合金中铝和镁的物质的量之比.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两烧杯中各盛放有100mL2mol/L的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,充分反应结束后测得生成的气体体积比为甲:乙=3:4,则加入铝粉的质量为( )
A.4.8gB.3.2gC.2.4gD.1.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置分别进行下列实验:将①中溶液滴入②中,按要求填写下列空格:

方案 | ①中物质 | ②中物质 | 填空编号及要求 |
实验1 | 滴加过酚酞的水 | Na2O2 | 写出会看到的现象①_____ |
实验2 | NaOH溶液 | 未打磨过的铝条 | 写出所发生反应的离子方程式 ②_____ |
实验3 | 盐酸 | NaAlO2溶液 | 画出生成沉淀量随盐酸的加入的变化图象 ③_____ |
实验4 | 稀盐酸 | Na2CO3与NaOH的混合溶液 | 已知生成气体量随盐酸的加入的变化图象如下,则原溶液中的Na2CO3与NaOH的物质的量浓度之比为 ④_____
|
实验5 | FeCl3和盐酸的混合液 | 等质量的铜、锌、铁三种金属的混合物 | 若反应后无固体剩余,则反应后的溶液中一定存在的阳离子是 ⑤_____ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相等的三种溶液:①H2CO3 ②NaOH ③Na2CO3溶液,下列说法不正确的是( )
A.水电离出的c(H+):③>①>②
B.溶液的pH:②>③>①
C.①和②等体积混合后的溶液:![]()
D.①和③等体积混合后的溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,向容积为![]() 的恒容密闭容器中充入一定量的CO和
的恒容密闭容器中充入一定量的CO和![]() ,发生如下反应:
,发生如下反应:![]() ,反应过程中测定的部分数据见表:
,反应过程中测定的部分数据见表:
反应时间/min |
|
|
0 | 0.30 | 0.60 |
20 | 0.10 | |
30 | 0.20 |
下列说法正确的是
A.保持其他条件不变,升高温度,平衡时![]() ,则反应的
,则反应的![]()
B.反应在![]() 内的平均速率为
内的平均速率为![]()
C.保持其他条件不变,再向平衡体系中同时通入![]() ,达到新平衡前v(正)<v(逆)
,达到新平衡前v(正)<v(逆)
D.相同温度下,若起始时向容器中充入![]() ,达到平衡时
,达到平衡时![]() 转化率大于
转化率大于![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com