
【题目】用下图所示装置分别进行下列实验:将①中溶液滴入②中,按要求填写下列空格:

方案 | ①中物质 | ②中物质 | 填空编号及要求 |
实验1 | 滴加过酚酞的水 | Na2O2 | 写出会看到的现象①_____ |
实验2 | NaOH溶液 | 未打磨过的铝条 | 写出所发生反应的离子方程式 ②_____ |
实验3 | 盐酸 | NaAlO2溶液 | 画出生成沉淀量随盐酸的加入的变化图象 ③_____ |
实验4 | 稀盐酸 | Na2CO3与NaOH的混合溶液 | 已知生成气体量随盐酸的加入的变化图象如下,则原溶液中的Na2CO3与NaOH的物质的量浓度之比为 ④_____
|
实验5 | FeCl3和盐酸的混合液 | 等质量的铜、锌、铁三种金属的混合物 | 若反应后无固体剩余,则反应后的溶液中一定存在的阳离子是 ⑤_____ |
【答案】溶液变红色随后褪去 Al2O3+2OH﹣=2AlO2﹣+H2O、2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑ 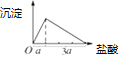 1:4 Fe2+、Zn2+、Cu2+、H+
1:4 Fe2+、Zn2+、Cu2+、H+
【解析】
1.根据过氧化钠和水反应生成氢氧化钠和氧气,氢氧化钠具有碱性,过氧化钠具有强氧化性分析实验现象。
2.根据铝和氧化铝和氢氧化钠的反应分析。
3.根据偏铝酸钠和少量的盐酸反应生成氢氧化铝沉淀,过量的盐酸能溶解氢氧化铝分析图像。
4.根据混合溶液中氢氧化钠先和盐酸反应,然后碳酸钠和盐酸反应生成碳酸氢钠和氯化铵,碳酸氢钠和盐酸再反应生成氯化钠和水和二氧化碳,结合图像数据分析。
5.根据金属性强弱和阳离子的氧化性强弱顺序分析反应的前后顺序。
实验1:过氧化钠和水反应生成氢氧化钠溶液,同时溶液中会生成少量过氧化氢具有氧化性能氧化有机色素,滴加过酚酞的水滴入过氧化钠固体粉碎反应生成氢氧化钠溶液和氧气,溶液变红色,随后红色褪去,
故答案为:溶液变红色随后褪去;
实验2:铝表面有氧化铝是两性氧化物溶于氢氧化钠溶液,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:Al2O3+2OH﹣=2AlO2﹣+H2O、2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,
故答案为:Al2O3+2OH﹣=2AlO2﹣+H2O、2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;
实验3:盐酸滴入偏铝酸钠溶液中先生成氢氧化铝白色沉淀,AlO2﹣+H++H2O=Al(OH)3↓,继续滴加沉淀溶解得到氯化铝溶液,Al(OH)3+3H+=Al3++3H2O,利用化学方程式定量关系,先产生沉淀,后沉淀溶解,所用稀盐酸溶液体积为1:3;绘制沉淀量随盐酸的加入的变化图象为: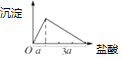 ,
,
故答案为: ;
;
实验4:稀盐酸滴入Na2CO3与NaOH的混合溶液,先和氢氧化钠溶液反应,NaOH+HCl=NaCl+2H2O,随后和碳酸钠溶液反应生成碳酸氢钠,Na2CO3+HCl=NaHCO3+NaCl,继续滴加开始生成二氧化碳气体,NaHCO3+HCl=NaCl+CO2↑+H2O,生成气体的量随盐酸的加入的变化图象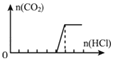 ,分析定量关系得到原溶液中的Na2CO3与NaOH的物质的量浓度之比为:1:4,
,分析定量关系得到原溶液中的Na2CO3与NaOH的物质的量浓度之比为:1:4,
故答案为:1:4;
实验5:FeCl3和盐酸的混合液滴入等质量的铜、锌、铁三种金属的混合物,还原性Zn>Fe>Cu,氧化性Fe3+>H+,氧化还原反应顺序进行,2Fe3++Zn=Zn2++2Fe2+、2Fe3++Fe=3Fe2+、2Fe3++Cu=2Fe2++Cu2+,若反应后无固体剩余,说明氢离子未反应,Fe3+离子可能存在或恰好完全反应,溶液中一定存在Fe2+、Zn2+、Cu2+、H+,
故答案为:Fe2+、Zn2+、Cu2+、H+。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,可逆反应:A2(g)+B2(g)![]() xC(g)符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是
xC(g)符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是

A.P3<P4,Y轴表示A2的转化率
B.P3>P4,Y轴表示A2的浓度
C.P3>P4,Y轴表示混合气体的密度
D.P3>P4,Y轴表示混合气体的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O
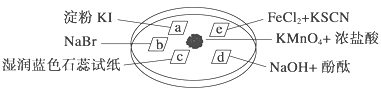
对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.18g氨基(-ND2)中含有的电子数为10NA
B.56gFe与1molCl2充分反应后转移电子的数目为3NA
C.向密闭容器中加入2molNO和1molO2,充分反应后容器中产物分子的数目为2NA
D.向100mL0.1mol/LNH4Cl溶液中通入NH3至溶液为中性,其中NH4+的数目为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铁铝合金与很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液x中,逐滴加入4molL﹣1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。则下列有关计算和判断正确的是( )
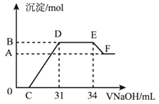
A.溶液x中所含的阳离子有:Al3+、H+、Fe3+、Fe2+
B.在DE段,发生反应的离子方程式为NH4++OH﹣→NH3H2O
C.无法求出B点对应的沉淀的物质的量
D.C点对应的氢氧化钠溶液的体积为7mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个化学方程式表示的是( )
A. 盐酸 Na2CO3溶液 B. 氢氧化钠溶液 AlCl3溶液
C. Cl2 铁粉 D. CO2 澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸(HCOOH)是还原性弱酸,常用于橡胶、医药等工业生产,也可用于制备重要的化工原料[Cu(HCOO)2·4H2O]。
I.碱式碳酸铜的制备
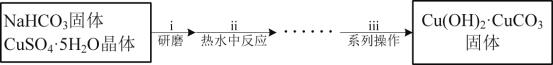
(1)“操作i”中研磨的目的是__。
(2)“操作ii”发生的反应是:2CuSO4+4NaHCO3═Cu(OH)2·CuCO3↓+3CO2↑+2Na2SO4+H2O。原料中NaHCO3必须过量的原因是__。反应温度低于80℃的原因是__。
(3)“操作iii”中系列操作包括过滤、__、干燥。
II.甲酸的制备
(4)一定条件下,CO能与NaOH固体发生反应:CO+NaOH![]() HCOONa,再将HCOONa酸化,即可得HCOOH。
HCOONa,再将HCOONa酸化,即可得HCOOH。
①为了证明“CO与NaOH固体发生了反应”,甲同学设计下列验证方案:取少许固体产物,配成溶液,在常温下测其pH,若pH>7,则得证。该方案是否可行__(填“是”或“否”),请简述你的理由:__。
②乙同学设计了另一个定性验证方案:取固体产物,配成溶液,__(请补充完整)。
III.甲酸铜的合成及纯度测定
(5)实验室按Cu(OH)2·CuCO3+4HCOOH+5H2O═2Cu(HCOO)2·4H2O+CO2↑反应制得甲酸铜晶体,按以下步骤测定其纯度。
步骤一:准确称取mg甲酸铜晶体样品,配成250mL溶液;
步骤二:移取25.00mL溶液于锥形瓶中,往溶液中加入足量KI摇匀,用cmol/LNa2S2O3溶液滴定至溶液变浅黄色时,加入10mL10%KSCN试剂,并加几滴淀粉溶液,继续用cmol/LNa2S2O3溶液滴定至终点,共消耗Na2S2O3溶液V1mL。
步骤三:用25.00mL蒸馏水代替甲酸铜溶液,重复步骤二,消耗Na2S2O3溶液V2mL;
已知:CuI难溶于水,能吸附I2;2Cu2++4I-=2CuI↓+I2;I2+2![]() =
=![]() +2I-;CuI(s)+SCN-(aq)
+2I-;CuI(s)+SCN-(aq)![]() CuSCN(s)+I-(aq)
CuSCN(s)+I-(aq)
①配制溶液时用到的玻璃仪器有:烧杯、量筒、玻璃棒和__;
②实验中加入10mL10%KSCN试剂的目的是__。
③甲酸铜晶体的纯度__(列表达式即可,Cu(HCOO)2·4H2O的摩尔质量为226g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以空气和镁为原料制备 Mg3N2 的装置如图所示(夹持和加热装置略去):
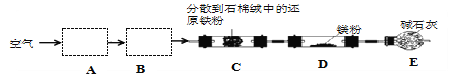
下列说法正确的是( )
A. 装置 A、B 中可依次加入浓硫酸、NaOH 溶液
B. 若去掉装置 C,对产品纯度无影响
C. 实验时应先加热 C,通入一段时间空气后再加热D
D. E 中碱石灰的作用是吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质性质的叙述正确的是( )
A.SiO2与浓盐酸在高温下能反应生成SiCl4
B.木炭与浓硫酸共热可生成CO2
C.明矾溶液中加入过量NaOH溶液可制备Al(OH)3胶体
D.向饱和食盐水中通入足量CO2可制得NaHCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com