
【题目】700℃时,向容积为![]() 的恒容密闭容器中充入一定量的CO和
的恒容密闭容器中充入一定量的CO和![]() ,发生如下反应:
,发生如下反应:![]() ,反应过程中测定的部分数据见表:
,反应过程中测定的部分数据见表:
反应时间/min |
|
|
0 | 0.30 | 0.60 |
20 | 0.10 | |
30 | 0.20 |
下列说法正确的是
A.保持其他条件不变,升高温度,平衡时![]() ,则反应的
,则反应的![]()
B.反应在![]() 内的平均速率为
内的平均速率为![]()
C.保持其他条件不变,再向平衡体系中同时通入![]() ,达到新平衡前v(正)<v(逆)
,达到新平衡前v(正)<v(逆)
D.相同温度下,若起始时向容器中充入![]() ,达到平衡时
,达到平衡时![]() 转化率大于
转化率大于![]()
【答案】A
【解析】
A.20min内△n(CO)=0.20mol,则△n(H2)=0.40mol,所以20min时容器内氢气的物质的为0.60mol-0.40mol=0.20mol,到30min时氢气的物质的量没有发生变化说明反应达到平衡,该过程中△n(CO)=0.20mol,△n(H2)=0.40mol,根据方程式可知平衡时n(CH3OH)=0.20mol,容器体积为1L,c(CH3OH)=0.20mol/L,温度升高c(CH3OH)减小,说明平衡左移,则正反应为放热反应,即△H<0,选项A正确;
B.容器体积为1L,20min内v(CO)=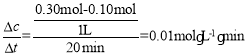 -1,同一时段内反应速率之比等于计量数之比,所以v(H2)=2 v(CO)=0.02mol·L-1·min-1,选项B错误;
-1,同一时段内反应速率之比等于计量数之比,所以v(H2)=2 v(CO)=0.02mol·L-1·min-1,选项B错误;
C.平衡时体系内n(CO)=0.10mol ,n(H2)=0.20mol,n(CH3OH)=0.20mol,若再通入0.10molCO、0.20mol H2、0.20mol CH3OH,同时将容器体积扩大为原来的2倍,则达到等效平衡,而保持其他条件不变,向容器中再通入0.20molCO、0.20mol H2、0.20mol CH3OH,相当于在等效平衡的基础上再加入0.10molCO,同时增大压强,则平衡右移,即v正>v逆,选项C错误;
D.初始投料为0.30molCO和0.60molH2,若完全反应则生成0.30mol CH3OH,即该温度下向容器内加入0.30mol CH3OH可以达到完全一样的平衡状态,平衡时n(CH3OH)=0.20mol,CH3OH的转化率为![]() ,而加入1mol CH3OH相当于等效平衡的基础上加压,反应
,而加入1mol CH3OH相当于等效平衡的基础上加压,反应![]() 的平衡会右移,导致CH3OH的转化率减小,选项D错误;
的平衡会右移,导致CH3OH的转化率减小,选项D错误;
答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.18g氨基(-ND2)中含有的电子数为10NA
B.56gFe与1molCl2充分反应后转移电子的数目为3NA
C.向密闭容器中加入2molNO和1molO2,充分反应后容器中产物分子的数目为2NA
D.向100mL0.1mol/LNH4Cl溶液中通入NH3至溶液为中性,其中NH4+的数目为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以空气和镁为原料制备 Mg3N2 的装置如图所示(夹持和加热装置略去):
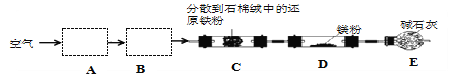
下列说法正确的是( )
A. 装置 A、B 中可依次加入浓硫酸、NaOH 溶液
B. 若去掉装置 C,对产品纯度无影响
C. 实验时应先加热 C,通入一段时间空气后再加热D
D. E 中碱石灰的作用是吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.2g Fe加入一定量的HNO3充分反应后,生成Fe2+、Fe3+的物质的量之比为1:4,将生成的气体与一定量的O2混合后通入水中,最后无气体剩余,则通入的氧气的物质的量是
A. 0.12mol B. 0.14mol
C. 0.2mol D. 0.13mol
【答案】B
【解析】
铁与硝酸反应生成Fe2+、Fe3+和氮的氧化物,氮的氧化物与一定量的O2混合后通入水中,最后无气体剩余,说明氮的氧化物与O2完全反应生成硝酸,铁还原硝酸的量与生成硝酸的量相同,即铁失去电子的数目与O2得到电子数目相同,据此计算。
由题意可知,铁还原硝酸的量与氮的氧化物与O2完全反应生成硝酸的量相同,即铁失去电子的数目与O2得到电子数目相同。11.2gFe的物质的量为0.2mol,Fe全部溶解,生成Fe2+和Fe3+的物质的量之比为1:4,所Fe2+的物质的量为0.04mol,Fe3+的物质的量为0.16mol,共失去电子为0.04mol×2+0.16mol×3=0.56mol,由得失电子守恒,O2得到电子的物质的量为0.56mol,所以O2的物质的量为0.56mol/4=0.14mol,故选B。
【点睛】
本题考查铁和硝酸反应的有关计算,该题的关键是在明确反应原理的基础上灵活运用电子得失守恒。
【题型】单选题
【结束】
23
【题目】10mLNO、CO2的混合气体通过足量的Na2O2后,气体的体积变为5mL(相同状况),则CO2和NO的体积比不可能为
A. 1∶1 B. 1∶2
C. 2∶1 D. 3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下所示:(单位:电荷)
粒子代号 | a | b | c | d | e | f | g |
电荷数 | 0 | +1 | -1 | 0 | +2 | +1 | 0 |
其中b的离子半径大于e的离子半径;c与f可形成两个共价型g分子。试写出:
(1)a粒子的原子结构示意图是______________。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为________(用化学式表示)。
(3)若d极易溶于水,在水溶液中变化的方程式为________,实验室制备d气体的化学方程式为________;若d为正四面体形分子,其重要应用之一为________。
(4)c粒子是________,f粒子是________(用化学式表示),由c、f生成g的离子方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 用于石油工业脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。实验室用
用于石油工业脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。实验室用![]() 混合溶液与
混合溶液与![]() 溶液反应制取
溶液反应制取![]() ,相关装置如图。回答以下问题:
,相关装置如图。回答以下问题:
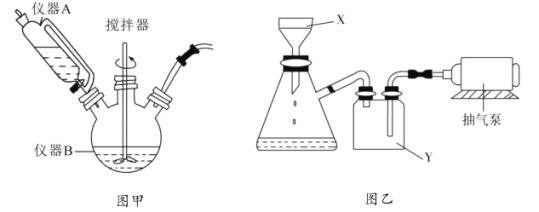
(1)图甲中仪器B的名称是__________,制备过程中![]() 过量会发生副反应生成
过量会发生副反应生成![]() ,为提高产率,仪器A中所加试剂应为__________________;
,为提高产率,仪器A中所加试剂应为__________________;
(2)丙图是体系pH随时间变化关系图,制取![]() 反应的离子方程式为____________,丁图是产率随pH变化关系图,实验过程中往往用
反应的离子方程式为____________,丁图是产率随pH变化关系图,实验过程中往往用![]() 混合溶液代替单一
混合溶液代替单一![]() 溶液,其中
溶液,其中![]() 的作用是____________;
的作用是____________;
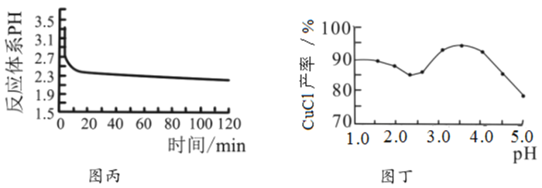
(3)反应完成后经抽滤、洗涤、干燥获得产品。抽滤装置如图乙所示,抽滤所用的仪器包括布氏漏斗、吸滤瓶、安全瓶和抽气泵。其中抽气泵的作用是使吸滤瓶与安全瓶中的____________________,跟常规过滤相比,采用抽滤的优点是____________(写一条);洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是__________________。
(4)![]() 不稳定易分解为
不稳定易分解为![]() ,
,![]() 时
时![]() 的
的![]() ,
,![]() 的
的![]() ,把
,把![]() 固体和
固体和![]() 溶液混合,加热,得到红色沉淀,该沉淀的化学式为___________。
溶液混合,加热,得到红色沉淀,该沉淀的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质性质的叙述正确的是( )
A.SiO2与浓盐酸在高温下能反应生成SiCl4
B.木炭与浓硫酸共热可生成CO2
C.明矾溶液中加入过量NaOH溶液可制备Al(OH)3胶体
D.向饱和食盐水中通入足量CO2可制得NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物是一类重要物质,下列叙述中正确的是( )
A.保存![]() 溶液常常加一些铁粉,其目的是抑制
溶液常常加一些铁粉,其目的是抑制![]() 水解
水解
B.![]() ,
,![]() 的溶液中,
的溶液中,![]() 、
、![]() 、
、![]() 、
、![]() 可以大量共存
可以大量共存
C.制备![]() 、
、![]() 均可采用将溶液直接蒸干灼烧的方法
均可采用将溶液直接蒸干灼烧的方法
D.铁粉加入到足量稀硝酸中:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com