
【题目】要证明某溶液中不含Fe3+而可能含有Fe2+,请你设计实验,简述操作过程,并写出必要的离子方程式_____________________
【答案】取样,向其中滴加KSCN溶液,无明显现象;再向其中滴加氯水,溶液呈血红色,涉及反应的离子方程式有①2Fe2++Cl2→2Fe3+2Cl-、②2Fe3++3SCN-![]() Fe(SCN)3。
Fe(SCN)3。
【解析】
KSCN与Fe3+作用使溶液显红色,与Fe2+作用无此现象,可以先检测不含Fe3+,再证明有有Fe3+。
因为KSCN与Fe3+作用使溶液显红色,与Fe2+作用无此现象,可以先滴加KSCN溶液,不显红色,说明原溶液不含有Fe3+,再滴加氯水后显红色,说明滴加氯水后溶液中有Fe3+,证明原溶液含有Fe2+,涉及反应的离子方程式有2Fe2++Cl2→2Fe3+2Cl-、2Fe3++3SCN-![]() Fe(SCN)3。
Fe(SCN)3。


科目:高中化学 来源: 题型:
【题目】物质的量浓度相等的三种溶液:①H2CO3 ②NaOH ③Na2CO3溶液,下列说法不正确的是( )
A.水电离出的c(H+):③>①>②
B.溶液的pH:②>③>①
C.①和②等体积混合后的溶液:![]()
D.①和③等体积混合后的溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,向容积为![]() 的恒容密闭容器中充入一定量的CO和
的恒容密闭容器中充入一定量的CO和![]() ,发生如下反应:
,发生如下反应:![]() ,反应过程中测定的部分数据见表:
,反应过程中测定的部分数据见表:
反应时间/min |
|
|
0 | 0.30 | 0.60 |
20 | 0.10 | |
30 | 0.20 |
下列说法正确的是
A.保持其他条件不变,升高温度,平衡时![]() ,则反应的
,则反应的![]()
B.反应在![]() 内的平均速率为
内的平均速率为![]()
C.保持其他条件不变,再向平衡体系中同时通入![]() ,达到新平衡前v(正)<v(逆)
,达到新平衡前v(正)<v(逆)
D.相同温度下,若起始时向容器中充入![]() ,达到平衡时
,达到平衡时![]() 转化率大于
转化率大于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔盐捕获CO2的装置如图所示。该装置工作时,下列说法正确的是( )

A.a为电源的负极
B.x极使用石墨不会损耗
C.y极电极反应式为CO32-+4e-=C+3O2-
D.电路中转移1 mol e-,理论上可捕获5.6 L CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如何除去杂质、提纯下列各物质?请在表中填空。
混合物成分 | 提纯所用试剂的化学式 | 离子方程式 |
(1)FeCl2中含少量FeCl3杂质 | _______ | __________________ |
(2)FeCl3中含少量FeCl2杂质 | _______ | __________________ |
(3)FeSO4中含少量CuSO4杂质 | _______ | __________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过对阳极泥的综合处理可以回收宝贵的金属,一种从铜阳极泥(主要成分为Se、Ag2Se、Ag、Cu、CuSO4和Cu2S等)中分离Ag、Se和Cu的新工艺流程如图所示:
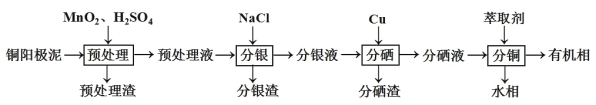
(1)已知预处理温度为80℃,预处理渣中几乎不含有单质S,则预处理时Cu2S发生反应的离子方程式为___。从环保角度来看,本工艺中采用稀H2SO4添加适量MnO2做预处理剂与传统工艺中采用浓硫酸作氧化剂相比的主要优点是___。
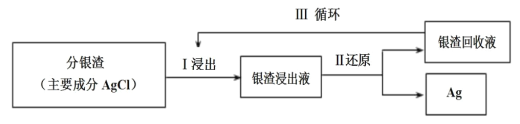
(2)回收分银渣中的银,可用如图过程:
已知:S2O![]() -易与银离子发生络合反应:Ag++2S2O
-易与银离子发生络合反应:Ag++2S2O![]()
![]() Ag(S2O3)
Ag(S2O3)![]() 。在常温下,上述络合反应的平衡常数为:K稳[Ag(S2O3)
。在常温下,上述络合反应的平衡常数为:K稳[Ag(S2O3)![]() ]=
]=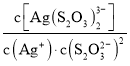 =2.8×1013,Ksp(AgCl)=1.8×10-10
=2.8×1013,Ksp(AgCl)=1.8×10-10
①Ⅰ中发生的离子反应方程式为:AgCl(s)+2S2O![]()
![]() Ag(S2O3)
Ag(S2O3) ![]() (aq)+Cl-(aq),则常温下此反应的平衡常数K为___(结果保留二位小数)。
(aq)+Cl-(aq),则常温下此反应的平衡常数K为___(结果保留二位小数)。
②Ⅲ中银渣回收液可直接循环使用,但循环多次后,银的浸出率会降低。从化学平衡的角度分析原因:___。
(3)分硒渣的主要成分是Cu2Se,可被氧化得到亚硒酸(H2SeO3)。已知常温下H2SeO3的Ka1=2.7×10-3,Ka2=2.5×10-8,则NaHSeO3溶液的pH___7(填“>”、“<”或“=”)。硒酸(H2SeO4)可以用氯水氧化亚硒酸得到,该反应化学方程式为___。
(4)分铜得到产品CuSO4·5H2O的具体操作如图:

其中萃取与反萃取原理为:2RH+Cu2+![]() R2Cu+2H+,反萃取剂最好选用___(填化学式)溶液。
R2Cu+2H+,反萃取剂最好选用___(填化学式)溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年9月,我国科研人员研制出Ti·H·Fe双温区催化剂,其中Ti—H区域和Fe区域的温度差可超过100℃。Ti—H—Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法错误的是( )
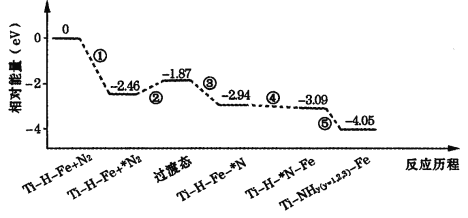
A.①②③在高温区发生,④⑤在低温区发生
B.在高温区加快了反应速率,低温区提高了氨的产率
C.该历程中能量变化最大的是2.46eV,是氮分子中氮氮三键的断裂过程
D.使用Ti—H—Fe双温区催化合成氨,不会改变合成氨反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铟产业被称为“信息时代的朝阳产业”。元素周期表中铟的数据见下图,下列说法正确的是( )
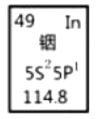
A.铟元素的质量数是114.8
B.铟元素的相对原子质量是115,中子数为66
C.铟元素是一种主族元素,位于第五周期第ⅢA族
D.铟原子最外层有5个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学想通过实验探究硫和碳得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验。

(1)仪器a的名称是________,应盛放下列药品中的________(填字母)。
A.稀硫酸 B.亚硫酸C.氢硫酸 D.盐酸
(2)仪器b的名称是________,应盛放下列药品中的________(填字母)。
A.碳酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3)仪器c中应盛放的试剂是________,如果看到的现象是____________________,证明b中反应产生了________,即可证明________比________酸性强,得电子能力________比________强,b中发生反应的离子方程式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com