
【题目】一种熔盐捕获CO2的装置如图所示。该装置工作时,下列说法正确的是( )

A.a为电源的负极
B.x极使用石墨不会损耗
C.y极电极反应式为CO32-+4e-=C+3O2-
D.电路中转移1 mol e-,理论上可捕获5.6 L CO2
【答案】C
【解析】
根据图片可知x极O2-→O2,发生氧化反应生成单质O2,所以x为阳极,y为阴极,阳极与电源正极相接、阴极与电源负极相接,即a极为电源正极、b极为电源负极,阳极反应式为2O2--4e-═O2![]() ,阴极电极反应式为:CO32-+4e-═C+3O2-,以此解答该题。
,阴极电极反应式为:CO32-+4e-═C+3O2-,以此解答该题。
A.根据上述分析,a极为电源正极,故A错误;
B.x极O2-→O2,在熔融条件下,石墨与氧气要反应,故石墨电极要损耗,故B错误;
C.y为阴极,CO32-得到电子生成C,电极反应式为:CO32-+4e-=C+3O2-,故C正确;
D.未描述标准状况,无法按标准状况下的气体摩尔体积计算CO2的体积,故D错误。
答案选C。


科目:高中化学 来源: 题型:
【题目】下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个化学方程式表示的是( )
A. 盐酸 Na2CO3溶液 B. 氢氧化钠溶液 AlCl3溶液
C. Cl2 铁粉 D. CO2 澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.2g Fe加入一定量的HNO3充分反应后,生成Fe2+、Fe3+的物质的量之比为1:4,将生成的气体与一定量的O2混合后通入水中,最后无气体剩余,则通入的氧气的物质的量是
A. 0.12mol B. 0.14mol
C. 0.2mol D. 0.13mol
【答案】B
【解析】
铁与硝酸反应生成Fe2+、Fe3+和氮的氧化物,氮的氧化物与一定量的O2混合后通入水中,最后无气体剩余,说明氮的氧化物与O2完全反应生成硝酸,铁还原硝酸的量与生成硝酸的量相同,即铁失去电子的数目与O2得到电子数目相同,据此计算。
由题意可知,铁还原硝酸的量与氮的氧化物与O2完全反应生成硝酸的量相同,即铁失去电子的数目与O2得到电子数目相同。11.2gFe的物质的量为0.2mol,Fe全部溶解,生成Fe2+和Fe3+的物质的量之比为1:4,所Fe2+的物质的量为0.04mol,Fe3+的物质的量为0.16mol,共失去电子为0.04mol×2+0.16mol×3=0.56mol,由得失电子守恒,O2得到电子的物质的量为0.56mol,所以O2的物质的量为0.56mol/4=0.14mol,故选B。
【点睛】
本题考查铁和硝酸反应的有关计算,该题的关键是在明确反应原理的基础上灵活运用电子得失守恒。
【题型】单选题
【结束】
23
【题目】10mLNO、CO2的混合气体通过足量的Na2O2后,气体的体积变为5mL(相同状况),则CO2和NO的体积比不可能为
A. 1∶1 B. 1∶2
C. 2∶1 D. 3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 用于石油工业脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。实验室用
用于石油工业脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。实验室用![]() 混合溶液与
混合溶液与![]() 溶液反应制取
溶液反应制取![]() ,相关装置如图。回答以下问题:
,相关装置如图。回答以下问题:
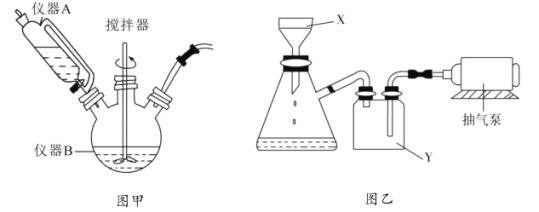
(1)图甲中仪器B的名称是__________,制备过程中![]() 过量会发生副反应生成
过量会发生副反应生成![]() ,为提高产率,仪器A中所加试剂应为__________________;
,为提高产率,仪器A中所加试剂应为__________________;
(2)丙图是体系pH随时间变化关系图,制取![]() 反应的离子方程式为____________,丁图是产率随pH变化关系图,实验过程中往往用
反应的离子方程式为____________,丁图是产率随pH变化关系图,实验过程中往往用![]() 混合溶液代替单一
混合溶液代替单一![]() 溶液,其中
溶液,其中![]() 的作用是____________;
的作用是____________;
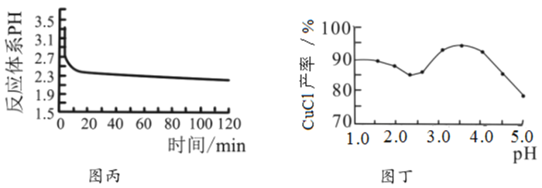
(3)反应完成后经抽滤、洗涤、干燥获得产品。抽滤装置如图乙所示,抽滤所用的仪器包括布氏漏斗、吸滤瓶、安全瓶和抽气泵。其中抽气泵的作用是使吸滤瓶与安全瓶中的____________________,跟常规过滤相比,采用抽滤的优点是____________(写一条);洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是__________________。
(4)![]() 不稳定易分解为
不稳定易分解为![]() ,
,![]() 时
时![]() 的
的![]() ,
,![]() 的
的![]() ,把
,把![]() 固体和
固体和![]() 溶液混合,加热,得到红色沉淀,该沉淀的化学式为___________。
溶液混合,加热,得到红色沉淀,该沉淀的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质性质的叙述正确的是( )
A.SiO2与浓盐酸在高温下能反应生成SiCl4
B.木炭与浓硫酸共热可生成CO2
C.明矾溶液中加入过量NaOH溶液可制备Al(OH)3胶体
D.向饱和食盐水中通入足量CO2可制得NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。氨水可用于工业尾气中SO2的吸收。下列指定溶液中微粒的物质的量浓度关系正确的是( )
A.氨水与SO2反应恰好生成(NH4)2SO3时:c(NH4+)>c(SO32-)>c(OH-)>c(H+)
B.氨水与SO2反应所得溶液pH=9时:c(NH4+)+c(H+)<3c(HSO3-)+c(OH-)
C.氨水与SO2反应生成等物质的量NH4HSO3和(NH4)2SO3时:3c(NH4+)+3c(NH3·H2O)=2c(SO32-)+2c(HSO3-)+2c(H2SO3)
D.氨水与SO2反应恰好生成NH4HSO3时:c(H+)+c(H2SO3)=c(OH-)+c(SO32-)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g)。若经2 s时测得C的浓度为0.6 mol·L-1,填写下列空白:
(1)用物质A表示反应的平均速率为_________。
(2)用物质B表示反应的平均速率为_________。
(3)2 s时物质A的转化率为_________。
(4)2 s时物质B的体积分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做如下实验,以探究反应中的能量变化。
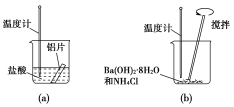
(1)在实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是________热反应;(b)中温度降低,由此可以判断(b)中反应是________热反应。
(2)写出铝与盐酸反应的离子方程式:_______________。
(3)根据能量守恒定律,(b)中反应物的总能量应该________生成物的总能量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com