
【题目】铟产业被称为“信息时代的朝阳产业”。元素周期表中铟的数据见下图,下列说法正确的是( )
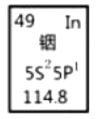
A.铟元素的质量数是114.8
B.铟元素的相对原子质量是115,中子数为66
C.铟元素是一种主族元素,位于第五周期第ⅢA族
D.铟原子最外层有5个电子
 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】11.2g Fe加入一定量的HNO3充分反应后,生成Fe2+、Fe3+的物质的量之比为1:4,将生成的气体与一定量的O2混合后通入水中,最后无气体剩余,则通入的氧气的物质的量是
A. 0.12mol B. 0.14mol
C. 0.2mol D. 0.13mol
【答案】B
【解析】
铁与硝酸反应生成Fe2+、Fe3+和氮的氧化物,氮的氧化物与一定量的O2混合后通入水中,最后无气体剩余,说明氮的氧化物与O2完全反应生成硝酸,铁还原硝酸的量与生成硝酸的量相同,即铁失去电子的数目与O2得到电子数目相同,据此计算。
由题意可知,铁还原硝酸的量与氮的氧化物与O2完全反应生成硝酸的量相同,即铁失去电子的数目与O2得到电子数目相同。11.2gFe的物质的量为0.2mol,Fe全部溶解,生成Fe2+和Fe3+的物质的量之比为1:4,所Fe2+的物质的量为0.04mol,Fe3+的物质的量为0.16mol,共失去电子为0.04mol×2+0.16mol×3=0.56mol,由得失电子守恒,O2得到电子的物质的量为0.56mol,所以O2的物质的量为0.56mol/4=0.14mol,故选B。
【点睛】
本题考查铁和硝酸反应的有关计算,该题的关键是在明确反应原理的基础上灵活运用电子得失守恒。
【题型】单选题
【结束】
23
【题目】10mLNO、CO2的混合气体通过足量的Na2O2后,气体的体积变为5mL(相同状况),则CO2和NO的体积比不可能为
A. 1∶1 B. 1∶2
C. 2∶1 D. 3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g)。若经2 s时测得C的浓度为0.6 mol·L-1,填写下列空白:
(1)用物质A表示反应的平均速率为_________。
(2)用物质B表示反应的平均速率为_________。
(3)2 s时物质A的转化率为_________。
(4)2 s时物质B的体积分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,下列有关表述错误的是( )
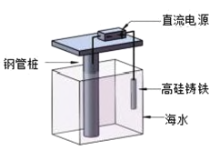
A.利用了电解原理B.电子由电源负极流向钢管桩
C.钢管桩是负极D.高硅铸铁作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温下![]() 碳酸氢钠溶液的
碳酸氢钠溶液的![]() 为8.4,则下列说法正确的是( )
为8.4,则下列说法正确的是( )
A.加入少量![]() 固体,钠离子和碳酸根离子浓度均增大
固体,钠离子和碳酸根离子浓度均增大
B.将该溶液加水稀释,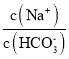 的比值保持不变
的比值保持不变
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物是一类重要物质,下列叙述中正确的是( )
A.保存![]() 溶液常常加一些铁粉,其目的是抑制
溶液常常加一些铁粉,其目的是抑制![]() 水解
水解
B.![]() ,
,![]() 的溶液中,
的溶液中,![]() 、
、![]() 、
、![]() 、
、![]() 可以大量共存
可以大量共存
C.制备![]() 、
、![]() 均可采用将溶液直接蒸干灼烧的方法
均可采用将溶液直接蒸干灼烧的方法
D.铁粉加入到足量稀硝酸中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做如下实验,以探究反应中的能量变化。
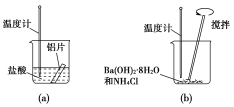
(1)在实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是________热反应;(b)中温度降低,由此可以判断(b)中反应是________热反应。
(2)写出铝与盐酸反应的离子方程式:_______________。
(3)根据能量守恒定律,(b)中反应物的总能量应该________生成物的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图装置中的变化叙述错误的是
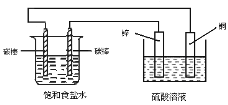
A.电子经导线从锌片流向右侧碳棒,再从左侧碳棒流回铜片
B.铜片上发生氧化反应
C.右侧碳棒上发生的反应:2H++2e→H2 ↑
D.铜电极出现气泡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com