
【题目】铁及其化合物是一类重要物质,下列叙述中正确的是( )
A.保存![]() 溶液常常加一些铁粉,其目的是抑制
溶液常常加一些铁粉,其目的是抑制![]() 水解
水解
B.![]() ,
,![]() 的溶液中,
的溶液中,![]() 、
、![]() 、
、![]() 、
、![]() 可以大量共存
可以大量共存
C.制备![]() 、
、![]() 均可采用将溶液直接蒸干灼烧的方法
均可采用将溶液直接蒸干灼烧的方法
D.铁粉加入到足量稀硝酸中:![]()
科目:高中化学 来源: 题型:
【题目】700℃时,向容积为![]() 的恒容密闭容器中充入一定量的CO和
的恒容密闭容器中充入一定量的CO和![]() ,发生如下反应:
,发生如下反应:![]() ,反应过程中测定的部分数据见表:
,反应过程中测定的部分数据见表:
反应时间/min |
|
|
0 | 0.30 | 0.60 |
20 | 0.10 | |
30 | 0.20 |
下列说法正确的是
A.保持其他条件不变,升高温度,平衡时![]() ,则反应的
,则反应的![]()
B.反应在![]() 内的平均速率为
内的平均速率为![]()
C.保持其他条件不变,再向平衡体系中同时通入![]() ,达到新平衡前v(正)<v(逆)
,达到新平衡前v(正)<v(逆)
D.相同温度下,若起始时向容器中充入![]() ,达到平衡时
,达到平衡时![]() 转化率大于
转化率大于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年9月,我国科研人员研制出Ti·H·Fe双温区催化剂,其中Ti—H区域和Fe区域的温度差可超过100℃。Ti—H—Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法错误的是( )
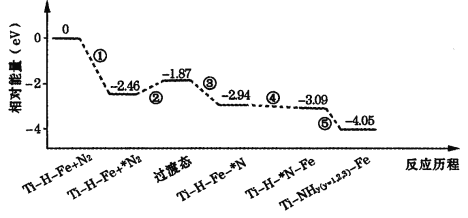
A.①②③在高温区发生,④⑤在低温区发生
B.在高温区加快了反应速率,低温区提高了氨的产率
C.该历程中能量变化最大的是2.46eV,是氮分子中氮氮三键的断裂过程
D.使用Ti—H—Fe双温区催化合成氨,不会改变合成氨反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铟产业被称为“信息时代的朝阳产业”。元素周期表中铟的数据见下图,下列说法正确的是( )
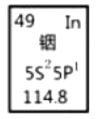
A.铟元素的质量数是114.8
B.铟元素的相对原子质量是115,中子数为66
C.铟元素是一种主族元素,位于第五周期第ⅢA族
D.铟原子最外层有5个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列实验仪器和实验操作的有关问题。


(1)图A中试管夹的作用是______________________。
(2)指出图B中的错误操作是____________________________________。
(3)图C、D是某同学配制50 g质量分数为6%的氯化钠溶液时,在称量和量取两个操作步骤中出现的情况:
①如图C所示:在称量氯化钠的操作过程中,发现指针偏右,则继续进行的操作是______________,至天平平衡。
②如图D所示,量取水时,仰视读数,所得溶液中溶质的质量分数会______________(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同的容器中,在不同的条件下进行合成氨反应:N2(g)+3H2(g)![]() 2NH3(g),根据下列在相同时间内测定的结果判断,生成氨的速率最快的是
2NH3(g),根据下列在相同时间内测定的结果判断,生成氨的速率最快的是
A.v(H2)=0.2mol·L-1·min-1
B.v(N2)=0.2 mol·L-1·min-1
C.v(N2)=0.02 mol·L-1·s-1
D.v(H2)= 0.04 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究用AgNO3溶液将混合溶液中的Cl-和CrO42-沉淀分离,绘制了25℃时AgCl和Ag2CrO4两种难溶化合物的溶解平衡曲线。其中,pAg+=-lgc(Ag+),其余离子类推。两条相交曲线把图像分成了X、Y、Z、M四个区域。下列说法错误的是( )
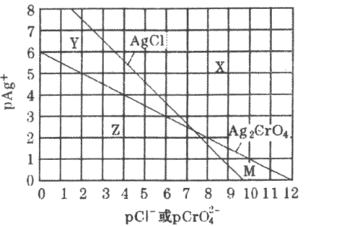
A.Ksp(Ag2CrO4)约为1×10-12,Ksp(AgCl)的数量级为10-10
B.M区域内可析出Ag2CrO4沉淀,而不析出AgCl沉淀
C.向Ag2CrO4,AgCl混合固体和水组成的溶解平衡体系中加入少量水,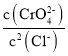 增大
增大
D.向Cl-,CrO42-均为0.1mol·L-1的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学想通过实验探究硫和碳得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验。

(1)仪器a的名称是________,应盛放下列药品中的________(填字母)。
A.稀硫酸 B.亚硫酸C.氢硫酸 D.盐酸
(2)仪器b的名称是________,应盛放下列药品中的________(填字母)。
A.碳酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3)仪器c中应盛放的试剂是________,如果看到的现象是____________________,证明b中反应产生了________,即可证明________比________酸性强,得电子能力________比________强,b中发生反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是
A.0.5 mol雄黄(As4S4)(结构如图:![]() )含有NA个S—S键
)含有NA个S—S键
B.1 mol CO和N2混合气体中含有的质子数为14NA
C.标准状况下,33.6L二氯甲烷中含有氯原子的数目为3NA
D.高温下,16.8 g Fe与足量水蒸气完全反应,转移的电子数为0.6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com