
【题目】支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,下列有关表述错误的是( )
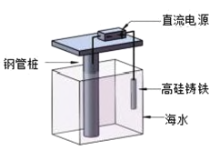
A.利用了电解原理B.电子由电源负极流向钢管桩
C.钢管桩是负极D.高硅铸铁作阳极
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在空气中泄露的二氧化硫,会被氧化而形成硫酸雾或硫酸盐气溶胶,污染环境。工业上常用![]() 溶液吸收、活性炭还原等方法处理二氧化硫,以减小对空气的污染。
溶液吸收、活性炭还原等方法处理二氧化硫,以减小对空气的污染。
(1)写出用![]() 溶液吸收
溶液吸收![]() 的离子方程式____________。
的离子方程式____________。
(2)钠原子核外有______种能量不同的电子。写出硫原子最外层电子的轨道表示式____________。
(3)![]() 比
比![]() 稳定,请用分子结构的知识简述其理由。__________________
稳定,请用分子结构的知识简述其理由。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性条件下,![]() 与
与![]() 按物质的量
按物质的量![]() 恰好完全反应,生成的产物能使淀粉溶液变蓝,请完成下列离子方程式的填空与配平。
恰好完全反应,生成的产物能使淀粉溶液变蓝,请完成下列离子方程式的填空与配平。
(________)H++(________)NO2-+(________)I-→(_________)+(__________)+(__________)H2O
根据上述离子方程式,1摩尔![]() 参与反应则转移的电子数目是______,反应中被还原的元素是______。
参与反应则转移的电子数目是______,反应中被还原的元素是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误的是( )

A. S2Cl2的结构式为Cl-S-S-Cl
B. S2Cl2为含有极性键和非极性键的非极性分子
C. S2Br2与S2Cl2结构相似,分子间作用力:S2Br2>S2Cl2
D. S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为周期表的一部分,其中的编号代表对应的元素。
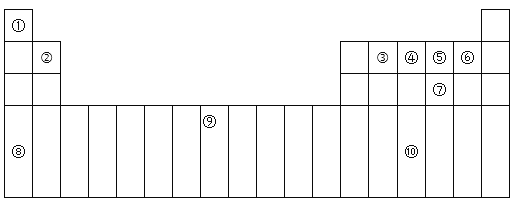
(1)在①~⑩元素的电负性最大的是:_____(填化学式)。
(2)⑨元素有____种运动状态不同的电子。
(3)⑩的基态原子的价电子排布式为:_________。
(4)⑤的氢化物与⑦的氢化物比较稳定的是:___,沸点较高的是:____(填化学式)。
(5)元素⑦和⑧形成的化合物属于____晶体,它比Na2O的熔点____(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常采取以下方法除去H2S和SO2以减少有害气体的排放。完成下列填空:
I.H2S的除去
用Fe2(SO4)3溶液吸收H2S生成FeSO4。FeSO4被O2氧化使Fe2(SO4)3再生,其原理为:□FeSO4+□O2+□H2SO4![]() □Fe2(SO4)3+□ 。
□Fe2(SO4)3+□ 。
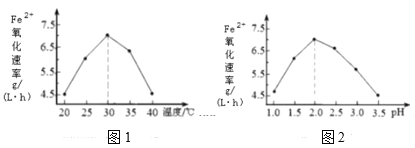
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍。由图1和图2判断,使用硫杆菌的最佳条件为__;若反应温度过高,反应速率下降,其原因是__。
(2)补全、配平Fe2(SO4)3再生的化学方程式,并标出电子转移的数目和方向。______。
(3)在一定条件下,也可以用H2O2氧化H2S,其氧化产物随参加反应的n(H2O2)/n(H2S)变化而不同,当n(H2O2)/n(H2S)=4时,氧化产物的化学式为__。
II.SO2的除去
用NaOH溶液吸收SO2,并用CaO使NaOH再生:NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
(4)写出过程①的离子方程式:___。
(5)CaO在水中存在如下转化:CaO(s)+H2O(l)=Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq)。从平衡移动的角度,简述过程②NaOH再生的原理____。
Ca2+(aq)+2OH-(aq)。从平衡移动的角度,简述过程②NaOH再生的原理____。
(6)也可用氨水除去SO2。某废气含0.2%SO2和10%SO2(体积含量,其余为N2),一定条件下,该废气以5m3/h的速率通过催化剂与速率为20L/h的NH3混合,再喷水,得到(NH4)2SO4晶体(气体体积均已折算为标准状况)。通过计算说明NH3速率控制在20L/h的原因。________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某样品中含有碳酸钠及少量的硫酸钠和氯化钠。某学生为了检验其成分,按照下图所示步骤进行实验。请根据表格中提示写出所加试剂及有关结论
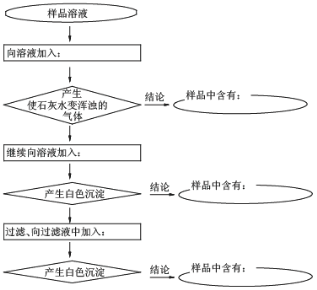
(1)向溶液中加入____________,样品中含有_______________;
(2)继续向溶液中加入_____________,样品中含有____________;
(3)过滤、向过滤液中加入___________,样品中含有___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.探究乙烯与溴的加成反应,甲同学设计并进行如下实验:先取一定量的工业用乙烯气体(在储气瓶中),使气体通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊物质,推测在工业上制得的乙烯中还可能含有少量还原性的气体杂质,由此他提出必须先除去杂质,然后再使乙烯与溴水反应。
请你回答下列问题:
(1)甲同学的实验中有关的化学方程式为___________。
(2)甲同学设计的实验____(填“能”或“不能”)验证乙烯与溴发生加成反应,其理由是____。
①使溴水褪色的反应,未必是加成反应 ②使溴水褪色的反应,就是加成反应
③使溴水褪色的物质,未必是乙烯 ④使溴水褪色的物质,就是乙烯
(3)乙同学推测此乙烯中必定含有的一种杂质气体是____。在验证过程中必须全部除去杂质气体,除去该杂质的试剂可选用________。
(4)为了验证乙烯与溴水的反应是加成反应而不是取代反应,可采取的方法有________。
II.探究苯与溴发生反应的原理用如图所示装置进行实验并分离提纯反应的产物。请回答下列问题:
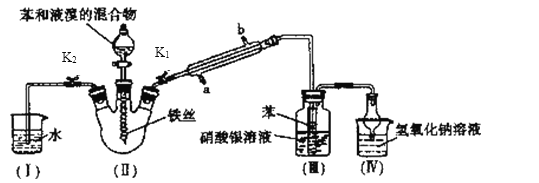
(1)冷凝管所起的作用为冷凝回流和导气,冷凝水从______口进入(填“a或“b”)。
(2)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。 Ⅲ中小试管内苯的作用是_____________。能说明苯与液溴发生了取代反应的现象是_____________。Ⅳ中球形干燥管的作用是_________________。
(3)欲结束实验时,需进行的操作为:待三颈烧瓶中的反应进行到仍有气泡冒出时,关闭分液漏斗活塞,再___________(填有关K1、K2的操作)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com