
【题目】酸性条件下,![]() 与
与![]() 按物质的量
按物质的量![]() 恰好完全反应,生成的产物能使淀粉溶液变蓝,请完成下列离子方程式的填空与配平。
恰好完全反应,生成的产物能使淀粉溶液变蓝,请完成下列离子方程式的填空与配平。
(________)H++(________)NO2-+(________)I-→(_________)+(__________)+(__________)H2O
根据上述离子方程式,1摩尔![]() 参与反应则转移的电子数目是______,反应中被还原的元素是______。
参与反应则转移的电子数目是______,反应中被还原的元素是______。
【答案】4 2 2 I2 2NO↑ 2 ![]()
![]()
【解析】
由题干中“生成的产物能使淀粉溶液变蓝”可知生成物中有I2,碘元素化合价升高了,![]() 中N元素处于中间价态,具有氧化性,由此可知该反应的的氧化剂
中N元素处于中间价态,具有氧化性,由此可知该反应的的氧化剂![]() 被还原为NO,KI被中I-被氧化为I2,然后根据氧化还原反应的化合价升降相等并结合电荷守恒以及原子守恒进行配平;根据方程式中化合价升降计算转移电子数并同时分析出被还原的元素。
被还原为NO,KI被中I-被氧化为I2,然后根据氧化还原反应的化合价升降相等并结合电荷守恒以及原子守恒进行配平;根据方程式中化合价升降计算转移电子数并同时分析出被还原的元素。
由上述分析可知,氧化剂NaNO2中N元素化合价从+3将为NO中的+2价,降低1个化合价,I-中的I元素化合价从-1价升高为0价,升高1个化合价,令NO2-系数为1,则I-系数为1,NO系数为1,I2系数为0.5,然后根据电荷守恒可知H+系数为2,H2O的系数为1,然后将方程式中所有系数乘以2,可配平方程式为:4H++2NO2-+2I-=I2+2NO↑+2H2O;
根据上述分析,当有1molKI参加反应时,I元素化合价升高1,其转移的电子数目为NA;被还原的元素是N;
故答案为:4;2;2;I2;2NO↑;2;![]() ;
;![]() 。
。


科目:高中化学 来源: 题型:
【题目】(1)赤水晒醋是我们遵义特产之一,其中含有一定量的CH3COOH。写出CH3COOH的电离方程式 ______;在已达平衡的乙酸溶液中加入一定的CH3COONa ,该溶液pH_______(填“增大”“减小”或“不变”)。
(2)燃料电池汽车,尤其是氢燃料电池汽车可以实现零污染、零排放,驱动系统几乎无噪音,且氢能取之不尽、用之不竭,因此燃料电池汽车成为汽车企业关注的焦点。燃料电池的燃料可以是氢气、甲醇等。有科技工作者利用稀土金属氧化物作为固体电解质制造出了甲醇—空气燃料电池。这种稀土金属氧化物在高温下能传导O2-。
①该电池的正极反应是___________;负极反应是____________。
②在稀土氧化物的固体电解质中,O2-的移动方向是__________。
③甲醇可以在内燃机中燃烧直接产生动力推动机动车运行,而科技工作者要花费大量的精力研究甲醇燃料汽车,主要原因是___________。
(3)在AgCl的饱和溶液中存在沉淀溶解平衡:AgCl(s) ![]() Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
①100 mL蒸馏水中;②100 mL 0.2 mol/L AgNO3溶液中;③100 mL 0.1 mol/L氯化铝溶液中;④100 mL 0.1 mol/L盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是_____(填写序号);其中②中氯离子的浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容容器中投入一定量纯净的氨基甲酸铵,发生下列反应NH2COONH4(s) ![]() 2NH3(g)+CO2(g)。能判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。能判断该分解反应已经达到化学平衡的是
A.2v(NH3)=v(CO2)
B.密闭容器中混合气体的密度不变
C.密闭容器中混合气体的平均摩尔质量不变
D.密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,固定容积的密闭容器中发生下列反应:![]() 反应过程中,各物质浓度与时间的关系如图:
反应过程中,各物质浓度与时间的关系如图:
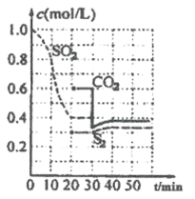
(1)该反应平衡常数表达式为![]() ____________。
____________。
(2)![]() 化学反应速率表示
化学反应速率表示![]() ______;建立平衡过程中,混合气体的密度______(选填“增大”、“减小”或“不变”)。
______;建立平衡过程中,混合气体的密度______(选填“增大”、“减小”或“不变”)。
(3)![]() 时改变外界条件,使
时改变外界条件,使![]() ______
______![]() (选填“大于”、“小于”或“等于”)。
(选填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人尝试用工业制纯碱原理来制备![]() 。他向饱和
。他向饱和![]() 溶液中依次通入足量的______和______两种气体,充分反应后有白色晶体析出。将得到的白色晶体洗涤后灼烧,结果无任何固体残留,且产生的气体能使澄清石灰水变浑浊。写出生成白色晶体的化学方程式:________。分析该方法得不到
溶液中依次通入足量的______和______两种气体,充分反应后有白色晶体析出。将得到的白色晶体洗涤后灼烧,结果无任何固体残留,且产生的气体能使澄清石灰水变浑浊。写出生成白色晶体的化学方程式:________。分析该方法得不到![]() 的原因可能是_______________。
的原因可能是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一个容积为2L的密闭容器中充入2mol NH3和3 mol O2,在恒温和催化剂作用下发生反应:4NH3(g)+5O2(g)4NO(g) + 6H2O(l) ,经过5min后达到平衡状态。此时,c(NH3):c(O2)=4:7。则:
(1)反应开始至平衡时,以NO的浓度变化表示该反应的平均速率v(NO)=__________。
(2)起始状态与平衡状态容器内的压强之比为______。
(3)该条件下反应一段时间,下列能说明反应达到平衡状态的是___________ 。
A.c(H2O)保持不变的状态 B.气体的压强保持不变的状态
C.4v正(NH3)=5v逆(O2) D.NH3与O2浓度之比保持不变的状态
(4)为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
A | B | C | D | E | F | |
4mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1 = _________ ,V6 = _________ 。
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,下列有关表述错误的是( )
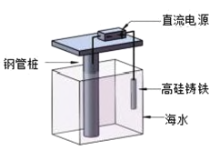
A.利用了电解原理B.电子由电源负极流向钢管桩
C.钢管桩是负极D.高硅铸铁作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-,SO42-和NO3-的相互分离,实验过程如下:
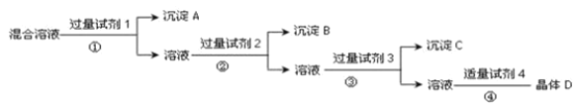
请回答下列问题:
(1)写出上述实验过程中所用试剂的名称:试剂1为 ___,试剂2为___,试剂4为_________。
(2)加入过量试剂3的目的是_________ 。
(3)在加入试剂4后,获得晶体D的实验操作④的名称是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)下列反应属于放热反应的是_______。
A.铝片与稀H2SO4反应制取H2
B.碳酸钙高温分解成氧化钙和二氧化碳
C.葡萄糖在人体内氧化分解
D.氢氧化钾和硫酸中和
E.Ba(OH)2·8H2O与NH4Cl固体反应
(2)一定条件下,2L密闭容器中SO2与O2反应5min后,若SO2和SO3物质的量分别为0.1 mol和0.3mol,则SO2起始物质的量浓度为_____;用O2表示这段时间该化学反应速率为______。
(3)用活性炭还原法处理氮氧化物。有关反应为C(s)+2NO(g)![]() N2(g)+CO2(g),某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,下列说法不能作为判断该反应达到化学平衡状态标志的是________(填选项字母)
N2(g)+CO2(g),某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,下列说法不能作为判断该反应达到化学平衡状态标志的是________(填选项字母)
A.活性炭的质量保持不变 B.v正(N2)=2v逆(NO)
C.容器内气体压强保持不变 D.容器内混合气体的密度保持不变
E.容器内混合气体的平均相对分子质量保持不变 F.容器内CO2的浓度保持不变
(4)利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能利用化学能,装置如图所示:
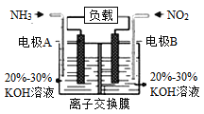
①A电极的电极反应式为_______________。
②下列关于该电池的说法正确的是___________(填选项字母)。
A.电子从右侧电极经过负载后流向左侧电极
B.离子交换膜为阴离子交换膜,则OH-由右侧溶液移向左侧溶液
C. 当有4.48L NO2被处理时,转移电子的物质的量为0.8mol
(5)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。已知: 1molN2和3molH2反应生成2molNH3时放出热量93kJ,试根据表中所列键能数据计算a的数值_________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com