
【题目】回答下列问题:
(1)下列反应属于放热反应的是_______。
A.铝片与稀H2SO4反应制取H2
B.碳酸钙高温分解成氧化钙和二氧化碳
C.葡萄糖在人体内氧化分解
D.氢氧化钾和硫酸中和
E.Ba(OH)2·8H2O与NH4Cl固体反应
(2)一定条件下,2L密闭容器中SO2与O2反应5min后,若SO2和SO3物质的量分别为0.1 mol和0.3mol,则SO2起始物质的量浓度为_____;用O2表示这段时间该化学反应速率为______。
(3)用活性炭还原法处理氮氧化物。有关反应为C(s)+2NO(g)![]() N2(g)+CO2(g),某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,下列说法不能作为判断该反应达到化学平衡状态标志的是________(填选项字母)
N2(g)+CO2(g),某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,下列说法不能作为判断该反应达到化学平衡状态标志的是________(填选项字母)
A.活性炭的质量保持不变 B.v正(N2)=2v逆(NO)
C.容器内气体压强保持不变 D.容器内混合气体的密度保持不变
E.容器内混合气体的平均相对分子质量保持不变 F.容器内CO2的浓度保持不变
(4)利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能利用化学能,装置如图所示:
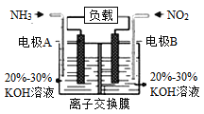
①A电极的电极反应式为_______________。
②下列关于该电池的说法正确的是___________(填选项字母)。
A.电子从右侧电极经过负载后流向左侧电极
B.离子交换膜为阴离子交换膜,则OH-由右侧溶液移向左侧溶液
C. 当有4.48L NO2被处理时,转移电子的物质的量为0.8mol
(5)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。已知: 1molN2和3molH2反应生成2molNH3时放出热量93kJ,试根据表中所列键能数据计算a的数值_________。

【答案】ACD 0.2 mol/L 0.015mol/(L·min) BC 2NH3-6e-+6OH-=N2+6H2O B 391
【解析】
根据放热和吸热反应的定义分析解答;根据化学键的键能与化学反应能量变化的关系分析解答;根据原电池原理分析解答。
(1)A.金属与稀酸反应是放热反应,故A符合题意;
B.碳酸钙高温分解成氧化钙和二氧化碳,是分解反应,该反应为吸热反应,故B不符合题意;
C.葡萄糖在人体内氧化分解,是放热反应,故C符合题意;
D. 氢氧化钾和硫酸中和,酸碱中和反应是放热反应,故D符合题意;
E.Ba(OH)2·8H2O与NH4Cl固体反应是吸热反应,故E不符合题意;
故选ACD。
(2)根据初始时加入的是SO2和O2,反应5min后,SO3物质的量0.3mol,则反应生成了SO30.3mol,2SO2(g)+O2(g)2SO3(g),根据转化量之比=化学计量数之比,则转化的SO2为0.3mol,转化的O2为0.15mol,由反应物初始量=转化量+剩余的量,计算出SO2起始物质的量=0.1mol+0.3mol=0.4mol,初始状态的SO2的物质的量浓度为:c(SO2)=![]() =0.2mol/L,v(O2)=
=0.2mol/L,v(O2)=![]() =
= =0.015mol/(Lmin),
=0.015mol/(Lmin),
故答案为:0.2mol/L;0.015mol/(Lmin);
(3)A.从反应方程式可知,反应前后气体体积不变,反应物的质量不再改变,即正反应速率与逆反应速率相等,说明反应达到化学平衡状态,故A不符合题意;
B.v正(N2)=2v逆(NO)即v正(N2):v逆(NO)=2:1,化学反应速率之比不等于化学计量数之比,故B符合题意;
C.该容器是恒容密闭容器,且反应前后气体体积不变,压强也保持不变,则不能判断反应是否达到平衡状态,故C符合题意;
D.混合气体的密度保持不变,说明气体的质量不变,反应达平衡状态,故D不符合题意;
E.达到平衡时,混合气体的质量不再改变,体积不变,即混合气体的平均相对分子质量保持不变,故E不符合题意;
F.容器内CO2的浓度不变,说明各物质的量不变,正逆反应速率相等,即反应达到平衡状态,故F不符合题意;
故选BC。
(4)①根据方程式可知,NH3失去电子,作还原剂,即A电极为负极,B电极为正极,则A电极的反应方程式为:2NH3-6e-+6OH-=N2+6H2O,故答案为:2NH3-6e-+6OH-=N2+6H2O;
②A.B电极为正极,电子由负极经外电路流向正极,故A错误;
B.原电池中,阴离子向负极移动,故B正确;
C.题干中未指出是否是标准状况下,所以不能计算,故C错误;
故选B。
(5)已知: 1molN2和3molH2反应生成2molNH3时放出热量93kJ,即 1molN≡N断裂吸收945kJ的能量,3molH—H断裂吸收436×3kJ的能量,6molN-H形成,放出6akJ的能量,则可得到等量关系为:6a-945-436×3=93,则a=391kJ;
故答案为:391。


科目:高中化学 来源: 题型:
【题目】把0.6molX气体和0.2molY气体混合于容积为2L的容器中,使其发生如下反应:3X(g)+Y(g)=nZ(g)+2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/ (L· min),则n的值为
A. 4B. 3C. 2D. 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应2AB+3C,在下列四种状态中,处于平衡状态的是( )
选项 | 正反应速率 | 逆反应速率 |
A | vA=2 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
B | vA=2 mol·L-1·min-1 | vC=2 mol·L-1·min-1 |
C | vA=1 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
D | vA=1 mol·L-1·min-1 | vC=1.5 mol·L-1·min-1 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂,在山坡坑道的仓库里贮有氯气钢瓶。一天一只贮有氯气的钢瓶损坏,造成氯气泄漏,在场工人采取的措施正确的是
A.把钢瓶推到坡下的小河里B.把钢瓶扔到农田中
C.把钢瓶丢到深坑里,用石灰填埋D.钢瓶处理后,工人应转移到坡上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋约占地球表面积的71%,对其开发利用的部分流程如图所示。下列说法错误的( )

①试剂1可以选用NaOH溶液;
②从苦卤中提取Br2的反应的离子方程式为:2Br-+Cl2=Br2+2Cl-
③工业上,电解熔融MgO冶炼金属镁可减小能耗;
④制铝:工业上电解熔融氯化铝来制备铝;
⑤制钠:电解饱和NaCl溶液;
⑥炼铁:CO在高温下还原铁矿石中的铁
A. ①②④⑥B. ②③④⑥C. ①③④⑥D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定条件下,向容积为2L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),CH3OH(g) + H2O(g)![]() CO2(g) + 3H2(g)
CO2(g) + 3H2(g) ![]() H(298K)=+ 49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则
H(298K)=+ 49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则
①达平衡时混合气体的压强是反应前的____________倍。
②该条件下反应达平衡状态的依据是(填序号)_______________。
A.v正(CH3OH)=v正(CO2) B.混合气体的密度不变
C.c(CH3OH)=c(H2O) D.混合气体的总物质的量不变
(2)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热Q kJ。则表示甲醇燃烧热的热化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。下列说法正确的是
A. 标况下,22.4L SO3含氧原子数为3NA
B. CO2 通过 Na2O2 使其增重 bg 时,反应中转移的电子数为 bNA/44
C. 2 molSO2和1 molO2在密闭容器中加热(V2O5催化)充分反应后,容器内分子总数大于2NA
D. 18gD2O和18gH2 O中含有的质子数均为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关燃烧热、中和反应反应热的叙述正确的是 ( )
①S(s)+3/2O2(g)===SO3(g) ΔH=-315 kJ·mol-1(燃烧热)(ΔH的数值正确)
②NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1(中和反应反应热)(ΔH的数值正确)
③已知CH3OH(l)的燃烧热为238.6 kJ·mol-1,则CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(g) ΔH=-238.6 kJ·mol-1
O2(g)===CO2(g)+2H2O(g) ΔH=-238.6 kJ·mol-1
④燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+![]() O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
⑤已知稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则稀醋酸与稀氢氧化钠溶液反应生成1 mol水时放出57.3 kJ的热量
⑥葡萄糖的燃烧热是2 800 kJ·mol-1,
则1/2C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1
A. ①② B. ②⑥ C. ②④ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁铵aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。
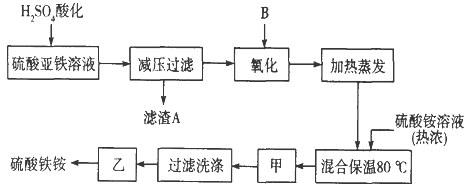
请回答下列问题:
(1)滤渣A的主要成分是__________________。
(2)下列物质中最适合的氧化剂B是________;反应的离子方程式__________________。
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲、乙的名称分别是:甲______________,乙___________________。
(4)上述流程中,氧化之后和加热蒸发之前,需取少量溶液检验Fe2+是否已全部被氧化,所加试剂能否用酸性的KMnO4溶液?____(填“能”或“不能”)理由是: ________________________。(可用语言或方程式说明)
(5)检验硫酸铁铵中NH4+的方法是________________________________________。
(6)称取14.00 g样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入0.05 mol Ba (NO3) 2溶液,恰好完全反应。则该硫酸铁铵的化学式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com