
【题目】一定条件下,可逆反应2AB+3C,在下列四种状态中,处于平衡状态的是( )
选项 | 正反应速率 | 逆反应速率 |
A | vA=2 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
B | vA=2 mol·L-1·min-1 | vC=2 mol·L-1·min-1 |
C | vA=1 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
D | vA=1 mol·L-1·min-1 | vC=1.5 mol·L-1·min-1 |
A. AB. BC. CD. D
【答案】D
【解析】
化学反应到达平衡时,同一物质的正逆反应速率相等,据此分析解答。
A.A物质的正反应速率υA=2mol/(l·min),逆反应速率υB=2mol/(l·min),则逆反应速率υA=4mol/(l·min),A的正逆反应速率不相等,所以该反应未达到平衡状态,故A错误;
B.同一反应中,各物质的反应速率之比等于计量数之比,A物质的正反应速率是2mol/(L·min),C的逆反应速率为2mol/(L·min),A的逆反应速率为![]() mol/(L·min),所以A的正逆反应速率不等,故B错误;
mol/(L·min),所以A的正逆反应速率不等,故B错误;
C.同一反应中,各物质的反应速率之比等于计量数之比,A物质的正反应速率是1 mol/(L·min),B的逆反应速率为2mol/(L·min),A的逆反应速率为4mol/(L·min),所以A的正逆反应速率不等,故C错误;
D.同一反应中,各物质的反应速率之比等于计量数之比,A物质的正反应速率是1 mol/(L·min),C的逆反应速率为1.5mol/(L·min),A的逆反应速率为1mol/(L·min),所以A的正逆反应速率相等,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】为了研究碳酸钙与盐酸反应的反应速率,某同学通过实验测定碳酸钙固体与足量稀盐酸反应生成CO2的体积随时间的变化情况,绘制出下图所示的曲线甲。下列有关说法中不正确的是

A. 在0-t1、t1-t2、t2-t3中,t1-t2生成的CO2气体最多
B. 因反应放热,导致0-t1内的反应速率逐渐增大
C. 若用单位时间内CO2的体积变化来表示该反应的速率,则t2-t3时间内平均反应速率为![]() mLs-1
mLs-1
D. 将碳酸钙固体研成粉末,则曲线甲将变成曲线乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平。E是具有果香味的有机物,D能与碳酸钠反应产生气体,F是一种高聚物,可制成多种包装材料。
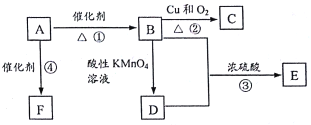
(1)A的结构式为___________。
(2)C分子中的官能团名称是_________,验证C物质存在该官能团的试剂是__________,现象为_________________________。
(3)写出下列反应的化学方程式并指出反应类型:
①____________________________:反应类型是______________;
③____________________________;反应类型是______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列有关说法正确的是
A. 用惰性电极电解NaH2PO2溶液,其阳极反应式为:2H2O-4e-=O2↑+4H+
B. H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O
C. 将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4
D. H3PO2溶于水的电离方程式为H3PO2![]() H++ H2PO2-
H++ H2PO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CH4催化还原NOx,可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
下列说法不正确的是( )
A. 若用标准状况下4.48 L CH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ
B. 由反应①可推知:CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(l) ΔH<-574 kJ·mol-1
C. 反应①②转移的电子数相同
D. 反应②中当4.48 L CH4反应完全时转移的电子总数为1.60 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
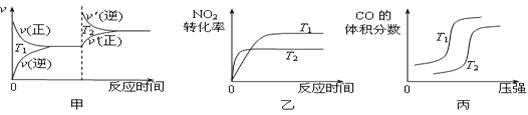
【题目】目前人们对环境保护、新能源开发很重视。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体。
4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是 (填代号)。
(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s) + 2NO(g) ![]() N2(g) + CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g) + CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率v(CO
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是 (填字母代号)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率 (填“升高”或“降低”),ΔH 0(填“>”或“<”).
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH= -l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH= +116.5kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式 。
(4)一种氨燃料电池,使用的电解质溶液是2mol/L的KOH溶液。
电池反应为:4NH3+3O2=2N2+6H2O;
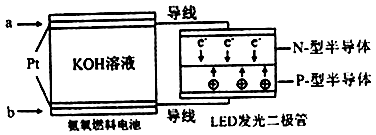
请写出通入a气体一极的电极反应式为 ;每消耗3.4g NH3转移电子的物质的量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高综合效益,而且还能防止环境污染,生产流程如下:

已知石油列解已成为生产H的重要方法,E的溶液能发生银镜反应,G是具有香味的液体,试填空。
(1)A的名称______;G的名称______。
(2)B的结构简式_______;H的结构简式____________。
(3)写出H发生加聚反应的方程式:_____________。
(4)D→E的化学方程式:_____________。
(5)E→F的化学方程式:_____________。
(6)F→G的化学方程式:_____________。
(7)写出G的同分异构体中与CH3COOH互为同系物的结构简式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)下列反应属于放热反应的是_______。
A.铝片与稀H2SO4反应制取H2
B.碳酸钙高温分解成氧化钙和二氧化碳
C.葡萄糖在人体内氧化分解
D.氢氧化钾和硫酸中和
E.Ba(OH)2·8H2O与NH4Cl固体反应
(2)一定条件下,2L密闭容器中SO2与O2反应5min后,若SO2和SO3物质的量分别为0.1 mol和0.3mol,则SO2起始物质的量浓度为_____;用O2表示这段时间该化学反应速率为______。
(3)用活性炭还原法处理氮氧化物。有关反应为C(s)+2NO(g)![]() N2(g)+CO2(g),某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,下列说法不能作为判断该反应达到化学平衡状态标志的是________(填选项字母)
N2(g)+CO2(g),某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,下列说法不能作为判断该反应达到化学平衡状态标志的是________(填选项字母)
A.活性炭的质量保持不变 B.v正(N2)=2v逆(NO)
C.容器内气体压强保持不变 D.容器内混合气体的密度保持不变
E.容器内混合气体的平均相对分子质量保持不变 F.容器内CO2的浓度保持不变
(4)利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能利用化学能,装置如图所示:
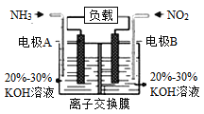
①A电极的电极反应式为_______________。
②下列关于该电池的说法正确的是___________(填选项字母)。
A.电子从右侧电极经过负载后流向左侧电极
B.离子交换膜为阴离子交换膜,则OH-由右侧溶液移向左侧溶液
C. 当有4.48L NO2被处理时,转移电子的物质的量为0.8mol
(5)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。已知: 1molN2和3molH2反应生成2molNH3时放出热量93kJ,试根据表中所列键能数据计算a的数值_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g) △H=﹣566kJ/mol
2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g) △H=﹣452kJ/mol

根据以上热化学方程式,下列判断不正确的是( )
A. 上图可表示由CO生成CO2的反应过程和能量关系
B. CO的燃烧热为283kJ/mol
C. 2 Na2O2(s)+2 CO2(s)=2 Na2CO3(s)+O2(g)△H>﹣452kJ/mol
D. CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com