
����Ŀ���������aFe2(SO4) 3��b(NH4) 2SO4��cH2O]�㷺���ڳ�����������ˮ����ҵѭ��ˮ�ľ��������ȡ�ij����������������������������ƣ��������Ϊԭ�ϣ���������¹���������ȡ������李�
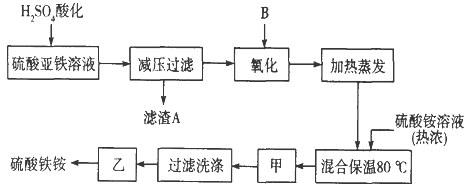
��ش��������⣺
��1������A����Ҫ�ɷ���__________________��
��2���������������ʺϵ�������B��________����Ӧ�����ӷ���ʽ__________________��
a��NaClO b��H2O2 c��KMnO4 d��K2Cr2O7
��3�������ס��ҵ����Ʒֱ��ǣ���______________����___________________��
��4�����������У�����֮��ͼ�������֮ǰ����ȡ������Һ����Fe2+�Ƿ���ȫ���������������Լ��ܷ������Ե�KMnO4��Һ��____(��ܡ����ܡ�)�����ǣ� ________________________�����������Ի�ʽ˵����
��5���������������NH4+�ķ�����________________________________________��
��6����ȡ14.00 g��Ʒ����������ˮ���Ƴ�100 mL��Һ���ֳ����ȷݣ�������һ���м�������NaOH��Һ������ϴ�ӵõ�2.14 g����������һ����Һ�м���0.05 mol Ba (NO3) 2��Һ��ǡ����ȫ��Ӧ�����������淋Ļ�ѧʽΪ______________________��
���𰸡�CaSO4bH2O2+2Fe2++2H+=2Fe3++2H2O��ȴ�ᾧ�������ɲ�����ΪH2O2��Fe2+����ʹ���Ե�KMnO4��Һ��ɫ���Թ��м���������Ʒ��NaOH������ȣ����Թܿ���ʪ��ĺ�ɫʯ����ֽ���飬������ֽ�����ɫFe2(SO4) 3��2(NH4) 2SO4��2H2O
��������
ԭ���м��������ữ������������Ƴ�������ѹ���˺�����������ɽ���������������������������������泥���80���·�Ӧ������������泥�������Ũ������ȴ�ᾧ������ϴ�ӣ��������ɹ�ɵ����������������
(1)�������ᣬ��������Һ��SO42-Ũ�ȣ���Ca2+ת��Ϊ����������CaSO4��ͬʱ����Fe2+ˮ�⣬�ʴ�Ϊ��CaSO4��
(2)Ϊ�������������ʣ�Ӧ�����������Ϊ����������ԭ������ˮ����Ӧ�����ӷ���ʽΪH2O2+2Fe2++2H+=2Fe3++2H2O���ʴ�Ϊ��b��H2O2+2Fe2++2H+=2Fe3++2H2O��
(3)��80���·�Ӧ������������泥�������Ũ������ȴ�ᾧ������ϴ�ӣ��������ɹ�ɵ�������������泥��¶Ȳ��ܹ��ߣ���ֹ�ֽ⣬�ʴ�Ϊ����ȴ�ᾧ��������ɹ��
(4)���Ը��������Һ�����Ժ�ǿ��H2O2��Fe2+����ʹ���Ե�KMnO4��Һ��ɫ��Ӧ����K3[Fe(CN)6]��Һ����������ɫ��������˵�������������ӣ��ʴ�Ϊ�����ܣ���ΪH2O2��Fe2+����ʹ���Ե�KMnO4��Һ��ɫ��
(5)����NH4+�ķ����Ǽ���ǿ�Ӧ�������ܹ�����ʹʪ��ĺ�ɫʯ����Һ���������壬�������ǰ������Ӷ�֤��ԭ��Һ��һ������NH4+���ʴ�Ϊ�����Թ��м���������Ʒ��NaOH������ȣ����Թܿ���ʪ��ĺ�ɫʯ����ֽ���飬������ֽ�����ɫ��
(6)��ȡ14.00g��Ʒ����������ˮ���ó�100mL��Һ���ֳ����ȷݣ�������һ���м�������NaOH��Һ������ϴ�ӵõ�2.14g������ӦΪFe(OH)3��n(Fe(OH)3)=![]() =0.02mol������14.00g��Ʒ�к���Fe2(SO4)30.02mol������һ����Һ�м���0.05mol Ba(NO3)2��Һ��ǡ����ȫ��Ӧ����n(SO42-)=0.05mol����n(SO42-)����Ϊ0.1mol�����(NH4)2SO4Ϊ0.1mol-0.02mol��3=0.04mol����m(H2O)=14.00g-0.02mol��400g/mol-0.04mol��132g/mol=0.72g��n(H2O)=
=0.02mol������14.00g��Ʒ�к���Fe2(SO4)30.02mol������һ����Һ�м���0.05mol Ba(NO3)2��Һ��ǡ����ȫ��Ӧ����n(SO42-)=0.05mol����n(SO42-)����Ϊ0.1mol�����(NH4)2SO4Ϊ0.1mol-0.02mol��3=0.04mol����m(H2O)=14.00g-0.02mol��400g/mol-0.04mol��132g/mol=0.72g��n(H2O)=![]() =0.04mol��n(Fe2(SO4)3)��n((NH4)2SO4)��n(H2O)=0.02��0.04��0.04=1��2��2�����Ի�ѧʽΪFe2(SO4)32(NH4)2SO42H2O���ʴ�Ϊ��Fe2(SO4)32(NH4)2SO42H2O��
=0.04mol��n(Fe2(SO4)3)��n((NH4)2SO4)��n(H2O)=0.02��0.04��0.04=1��2��2�����Ի�ѧʽΪFe2(SO4)32(NH4)2SO42H2O���ʴ�Ϊ��Fe2(SO4)32(NH4)2SO42H2O��


 ����ʦ��Сһ����ʦ������ҵϵ�д�
����ʦ��Сһ����ʦ������ҵϵ�д� ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش���������:
(1)���з�Ӧ���ڷ��ȷ�Ӧ����_______��
A.��Ƭ��ϡH2SO4��Ӧ��ȡH2
B.̼��Ƹ��·ֽ�������ƺͶ�����̼
C.�������������������ֽ�
D.�������غ������к�
E.Ba(OH)2��8H2O��NH4Cl���巴Ӧ
(2)һ�������£�2L�ܱ�������SO2��O2��Ӧ5min����SO2��SO3���ʵ����ֱ�Ϊ0.1 mol��0.3mol����SO2��ʼ���ʵ���Ũ��Ϊ_____����O2��ʾ���ʱ��û�ѧ��Ӧ����Ϊ______��
(3)�û���̿��ԭ��������������йط�ӦΪC(s)+2NO(g)![]() N2(g)+CO2(g)��ij�о�С��������ܱ������м���һ�����Ļ���̿��NO�����£�T�棩�����·�Ӧ������˵��������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��־����________����ѡ����ĸ��
N2(g)+CO2(g)��ij�о�С��������ܱ������м���һ�����Ļ���̿��NO�����£�T�棩�����·�Ӧ������˵��������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��־����________����ѡ����ĸ��
A.����̿���������ֲ��� B.v����N2��=2v����NO��
C.����������ѹǿ���ֲ��� D.�����ڻ��������ܶȱ��ֲ���
E.�����ڻ�������ƽ����Է����������ֲ��� F.������CO2��Ũ�ȱ��ֲ���
(4)���÷�Ӧ6NO2+8NH3=7N2+12H2O���ɵ�صķ���������ʵ����Ч��������������ŷţ����ỷ����Ⱦ���������û�ѧ�ܣ�װ����ͼ��ʾ��
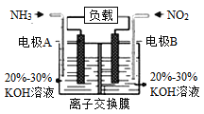
��A�缫�ĵ缫��ӦʽΪ_______________��
�����й��ڸõ�ص�˵����ȷ����___________����ѡ����ĸ����
A.���Ӵ��Ҳ�缫�������غ��������缫
B.���ӽ���ĤΪ�����ӽ���Ĥ����OH-���Ҳ���Һ���������Һ
C. ����4.48L NO2������ʱ��ת�Ƶ��ӵ����ʵ���Ϊ0.8mol
(5)�ӻ�ѧ���ĽǶȷ�������ѧ��Ӧ�Ĺ��̾��Ƿ�Ӧ��Ļ�ѧ�����ƻ���������Ļ�ѧ�����γɹ��̡���֪: 1molN2��3molH2��Ӧ����2molNH3ʱ�ų�����93kJ���Ը��ݱ������м������ݼ���a����ֵ_________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��2CO��g��+O2��g��=2CO2��g�� ��H=��566kJ/mol
2Na2O2��s��+2CO2��g��=2Na2CO3��s��+O2��g�� ��H=��452kJ/mol

���������Ȼ�ѧ����ʽ�������жϲ���ȷ���ǣ� ��
A. ��ͼ�ɱ�ʾ��CO����CO2�ķ�Ӧ���̺�������ϵ
B. CO��ȼ����Ϊ283kJ/mol
C. 2 Na2O2��s��+2 CO2��s��=2 Na2CO3��s��+O2��g����H����452kJ/mol
D. CO��g����Na2O2��s����Ӧ�ų�509kJ����ʱ������ת����Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ��ͭ-пԭ��أ���������ҺΪ����ͭ��Һ�����й��ڸõ�ص�˵���������
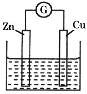
A. п�缫Ϊ����������������Ӧ
B. ���Ӵ�п�缫��������ͭ��Һ����ͭ�缫
C. ͭ�缫�Ϸ����ķ�ӦΪCu2��+2e��=Cu
D. �������Һ�е�SO42����п�缫�ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z�����ֳ����Ķ�����Ԫ�أ���ԭ�Ӱ뾶��ԭ�������仯��ͼ��ʾ����֪W��һ�ֺ��ص�������Ϊ18��������Ϊ10��X��Neԭ�ӵĺ�����������l��Y�ĵ�����һ�ֳ����İ뵼����ϣ�Z�ķǽ�������ͬ����Ԫ������ǿ������˵������ȷ����( )
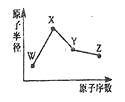
A. ��Ӧ�����Ӱ뾶��W��X
B. ��Ӧ��̬�⻯����ȶ��ԣ�Y��Z
C. ������XZW�Ⱥ����Ӽ����ֺ����Թ��ۼ�
D. Z���⻯���X������������Ӧˮ�������Һ������Y�������ﷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��װ��(1)Ϊ����(Fe-Ni)�ɳ����:Fe+Ni2O3+3H2O ![]() Fe(OH)2+2Ni(OH)2;װ��(��)Ϊ���ʾ��ͼ�����պϿ���Kʱ,�缫Y������Һ�ȱ�졣����˵����ȷ����
Fe(OH)2+2Ni(OH)2;װ��(��)Ϊ���ʾ��ͼ�����պϿ���Kʱ,�缫Y������Һ�ȱ�졣����˵����ȷ����
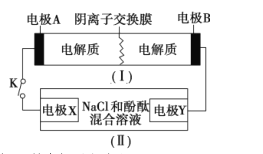
A. �պϿ���Kʱ,�缫X�ĵ缫��ӦʽΪ2H++2e-===H2��
B. �պϿ���Kʱ,�缫A�ĵ缫��ӦʽΪNi2O3+2e-+2H++H2O===2Ni(OH)2
C. ��װ��(I)���ʱ,�缫B�ϲ��뷴Ӧ�����ʱ�����
D. ��װ��(I)���ʱ,OHͨ�������ӽ���Ĥ����缫A
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��t ��ʱ����һ�����Ļ���������ܱ������з�����Ӧ��aA(g)��bB(g) ![]() cC(g)��dD(g)��ƽ�����B�����Ũ��Ϊ0.6 mol��L��1�������£����ܱ��������ݻ�����1�������´ﵽƽ����B�����Ũ��Ϊ0.4 mol��L��1��������������ȷ����
cC(g)��dD(g)��ƽ�����B�����Ũ��Ϊ0.6 mol��L��1�������£����ܱ��������ݻ�����1�������´ﵽƽ����B�����Ũ��Ϊ0.4 mol��L��1��������������ȷ����
A. ���´ﵽƽ��ʱ��D�����������С B. a��b<c��d
C. ���´ﵽƽ��ʱ��A�����Ũ������ D. ƽ�������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼ�ϵ����Ŀǰ����о����ȵ�֮һ������ij����С�����Ƶ�����ȼ�ϵ�أ���ͼ��ʾ��a��b��Ϊ���Ե缫��������������ȷ����(����)
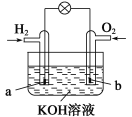
A��a�����������õ缫�Ϸ���������Ӧ
B��b����Ӧ��O2��4OH����4e��===2H2O
C���ܷ�Ӧ����ʽΪ2H2��O2===2H2O
D������ȼ�ϵ����һ�־���Ӧ��ǰ������ɫ��Դ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������(N2H4)Ϊȼ�ϵ����ͻ�����صĹ���ԭ����ͼ��ʾ������˵����ȷ����
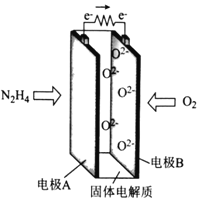
A. �缫A�ĵ��Ʊȵ缫B�ĵ�
B. �缫A�ĵ缫��ӦʽΪN2H4��4e��+4OH��===N2+4H2O
C. �缫B����������Ӧ
D. ÿ����11.2L��O2��ת�Ƶĵ�����Ϊ2NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com