
【题目】通过对阳极泥的综合处理可以回收宝贵的金属,一种从铜阳极泥(主要成分为Se、Ag2Se、Ag、Cu、CuSO4和Cu2S等)中分离Ag、Se和Cu的新工艺流程如图所示:
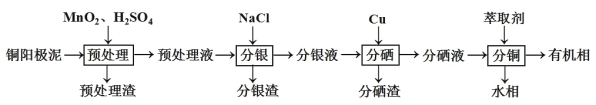
(1)已知预处理温度为80℃,预处理渣中几乎不含有单质S,则预处理时Cu2S发生反应的离子方程式为___。从环保角度来看,本工艺中采用稀H2SO4添加适量MnO2做预处理剂与传统工艺中采用浓硫酸作氧化剂相比的主要优点是___。
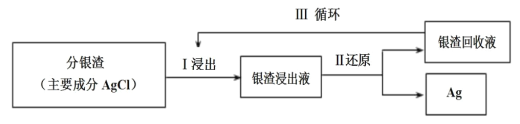
(2)回收分银渣中的银,可用如图过程:
已知:S2O![]() -易与银离子发生络合反应:Ag++2S2O
-易与银离子发生络合反应:Ag++2S2O![]()
![]() Ag(S2O3)
Ag(S2O3)![]() 。在常温下,上述络合反应的平衡常数为:K稳[Ag(S2O3)
。在常温下,上述络合反应的平衡常数为:K稳[Ag(S2O3)![]() ]=
]=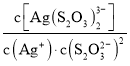 =2.8×1013,Ksp(AgCl)=1.8×10-10
=2.8×1013,Ksp(AgCl)=1.8×10-10
①Ⅰ中发生的离子反应方程式为:AgCl(s)+2S2O![]()
![]() Ag(S2O3)
Ag(S2O3) ![]() (aq)+Cl-(aq),则常温下此反应的平衡常数K为___(结果保留二位小数)。
(aq)+Cl-(aq),则常温下此反应的平衡常数K为___(结果保留二位小数)。
②Ⅲ中银渣回收液可直接循环使用,但循环多次后,银的浸出率会降低。从化学平衡的角度分析原因:___。
(3)分硒渣的主要成分是Cu2Se,可被氧化得到亚硒酸(H2SeO3)。已知常温下H2SeO3的Ka1=2.7×10-3,Ka2=2.5×10-8,则NaHSeO3溶液的pH___7(填“>”、“<”或“=”)。硒酸(H2SeO4)可以用氯水氧化亚硒酸得到,该反应化学方程式为___。
(4)分铜得到产品CuSO4·5H2O的具体操作如图:

其中萃取与反萃取原理为:2RH+Cu2+![]() R2Cu+2H+,反萃取剂最好选用___(填化学式)溶液。
R2Cu+2H+,反萃取剂最好选用___(填化学式)溶液。
【答案】Cu2S+5MnO2+12H+=2Cu2++SO42-+5Mn2++6H2O 减少污染性气体SO2的排放 5.04×103 随循环次数增加,浸出液中c(Cl-)增大,AgCl(s)+2S2O32-(aq)![]() Ag(S2O3)23-(aq)+Cl-(aq)平衡左移,故浸出率下降 < H2SeO3+Cl2+H2O=H2SeO4+2HCl H2SO4
Ag(S2O3)23-(aq)+Cl-(aq)平衡左移,故浸出率下降 < H2SeO3+Cl2+H2O=H2SeO4+2HCl H2SO4
【解析】
铜阳极泥(主要成分为Se、Ag2Se、Ag、Cu、CuSO4和Cu2S等) ,加入二氧化锰、硫酸进行预处理,可将Cu2S氧化生成硫酸铜,减少污染物的排放,滤液加入NaCl,可生成AgCl,滤液加入Cu,得到Cu2Se,分硒液含有铜,萃取得到R2Cu,经反萃取可得铜的水溶液,可用于制备硫酸铜晶体等。
(1)预处理温度为80°C,预处理渣中几乎不含S元素,应生成硫酸盐,预处理时Cu2S发生反应的离子方程式为:Cu2S+5MnO2+12H+=2Cu2++SO42-+5Mn2++6H2O;采用稀H2SO4溶液添加MnO2做预处理剂,稀硫酸提供了酸性环境,MnO2作氧化剂,可以氧化Cu2S,若用浓硫酸作氧化剂,浓硫酸中+6价的S会被还原为+4价,产生二氧化硫,污染空气;
(2)①Ⅰ中发生的离子反应方程式为:AgCl(s)+2S2O![]()
![]() Ag(S2O3)
Ag(S2O3) ![]() (aq)+Cl-(aq),该反应的平衡常数
(aq)+Cl-(aq),该反应的平衡常数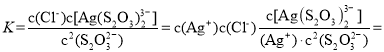
![]() ;
;
②Ⅲ中银渣回收液可直接放入Ⅰ过程循环使用,方程式为:AgCl(s)+2S2O![]()
![]() Ag(S2O3)
Ag(S2O3) ![]() (aq)+Cl-(aq),多次循环后,浸出液中S2O
(aq)+Cl-(aq),多次循环后,浸出液中S2O![]() 的浓度减小,Cl-的浓度增大,平衡向逆向移动,浸出率下降;
的浓度减小,Cl-的浓度增大,平衡向逆向移动,浸出率下降;
(3)常温下![]() 的水解平衡常数为
的水解平衡常数为![]() ,
,![]() 的电离平衡常数为2.5×10-8,故Kh<Ka2,即
的电离平衡常数为2.5×10-8,故Kh<Ka2,即![]() 的水解小于电离,所以NaHSeO3溶液显酸性,pH<7;亚硒酸被氯水中的氯气氧化为硒酸,氯气的0价氯降为-1价,方程式为:H2SeO3+Cl2+H2O=H2SeO4+2HCl;
的水解小于电离,所以NaHSeO3溶液显酸性,pH<7;亚硒酸被氯水中的氯气氧化为硒酸,氯气的0价氯降为-1价,方程式为:H2SeO3+Cl2+H2O=H2SeO4+2HCl;
(4)反萃取后生成CuSO4,根据萃取原理2RH+Cu2+![]() R2Cu+2H+,则应增大氢离子浓度,使平衡逆向移动,同时不引入新杂质,所以选择H2SO4作反萃取剂;
R2Cu+2H+,则应增大氢离子浓度,使平衡逆向移动,同时不引入新杂质,所以选择H2SO4作反萃取剂;


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+n(B)(g) ![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
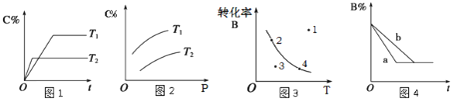
A.由图1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n<p
C.图3中,表示反应速率v(正)>v(逆)的是点3
D.图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 用于石油工业脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。实验室用
用于石油工业脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。实验室用![]() 混合溶液与
混合溶液与![]() 溶液反应制取
溶液反应制取![]() ,相关装置如图。回答以下问题:
,相关装置如图。回答以下问题:
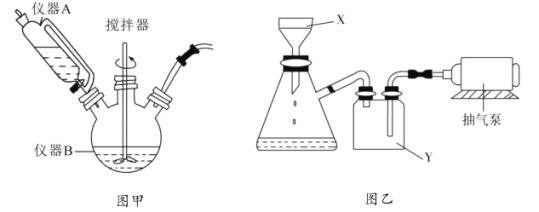
(1)图甲中仪器B的名称是__________,制备过程中![]() 过量会发生副反应生成
过量会发生副反应生成![]() ,为提高产率,仪器A中所加试剂应为__________________;
,为提高产率,仪器A中所加试剂应为__________________;
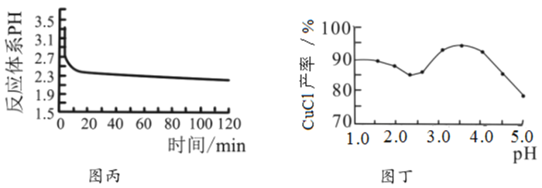
(2)丙图是体系pH随时间变化关系图,制取![]() 反应的离子方程式为____________,丁图是产率随pH变化关系图,实验过程中往往用
反应的离子方程式为____________,丁图是产率随pH变化关系图,实验过程中往往用![]() 混合溶液代替单一
混合溶液代替单一![]() 溶液,其中
溶液,其中![]() 的作用是____________;
的作用是____________;
(3)反应完成后经抽滤、洗涤、干燥获得产品。抽滤装置如图乙所示,抽滤所用的仪器包括布氏漏斗、吸滤瓶、安全瓶和抽气泵。其中抽气泵的作用是使吸滤瓶与安全瓶中的____________________,跟常规过滤相比,采用抽滤的优点是____________(写一条);洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是__________________。
(4)![]() 不稳定易分解为
不稳定易分解为![]() ,
,![]() 时
时![]() 的
的![]() ,
,![]() 的
的![]() ,把
,把![]() 固体和
固体和![]() 溶液混合,加热,得到红色沉淀,该沉淀的化学式为___________。
溶液混合,加热,得到红色沉淀,该沉淀的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。氨水可用于工业尾气中SO2的吸收。下列指定溶液中微粒的物质的量浓度关系正确的是( )
A.氨水与SO2反应恰好生成(NH4)2SO3时:c(NH4+)>c(SO32-)>c(OH-)>c(H+)
B.氨水与SO2反应所得溶液pH=9时:c(NH4+)+c(H+)<3c(HSO3-)+c(OH-)
C.氨水与SO2反应生成等物质的量NH4HSO3和(NH4)2SO3时:3c(NH4+)+3c(NH3·H2O)=2c(SO32-)+2c(HSO3-)+2c(H2SO3)
D.氨水与SO2反应恰好生成NH4HSO3时:c(H+)+c(H2SO3)=c(OH-)+c(SO32-)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL含有1mol/L的氯化铝和一定量盐酸的溶液中逐滴加入浓度为1mol/L的氢氧化钠溶液,产生沉淀的质量与所加碱的体积如图所示:
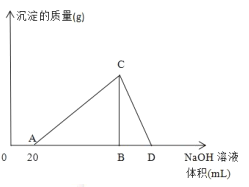
(1)写出AC段和CD段发生反应的离子方程式:
AC_______________________________________
CD_______________________________________
(2)盐酸溶液的浓度是____________________。
(3)若产生0.78g白色沉淀,则加入的氢氧化钠溶液的体积可能是__________________。
(4)D点表示的氢氧化钠溶液的体积是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g)。若经2 s时测得C的浓度为0.6 mol·L-1,填写下列空白:
(1)用物质A表示反应的平均速率为_________。
(2)用物质B表示反应的平均速率为_________。
(3)2 s时物质A的转化率为_________。
(4)2 s时物质B的体积分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温下![]() 碳酸氢钠溶液的
碳酸氢钠溶液的![]() 为8.4,则下列说法正确的是( )
为8.4,则下列说法正确的是( )
A.加入少量![]() 固体,钠离子和碳酸根离子浓度均增大
固体,钠离子和碳酸根离子浓度均增大
B.将该溶液加水稀释,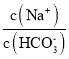 的比值保持不变
的比值保持不变
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M(C16H14O2)是一种香料,工业上常利用烃A和甲苯为主要原料,按下列路线合成:

已知:①气态烃A在标准状况下的密度是1.25g·L-1;
②醛在碱性溶液中能发生羟醛缩合反应,再脱水生成不饱和醛:
![]() 请回答下列问题:
请回答下列问题:
(1)F的名称是_______________;M中含有的官能团名称是________________。
(2)写出B→C的化学方程式_______________________________________。
(3)D→E的反应类型是___________________;K的结构简式是______________________。
(4)同时满足下列条件的G的同分异构体有________________种(不考虑立体异构)。
①含有碳碳三键
②遇FeCl3溶液发生显色反应
其中核磁共振氢谱为四组峰的结构简式为______________________。
(5)以乙醛为起始原料,选用必要的无机试剂合成1-丁烯,写出合成路线________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com