
 和8mol
和8mol 在一定条件下反应,达到平衡时,
在一定条件下反应,达到平衡时, 的转化率为25%,则平衡时氨气的体积分数接近于
的转化率为25%,则平衡时氨气的体积分数接近于 | A.5% | B.10% | C.15% | D.20% |
 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源:不详 题型:单选题
 2C(g)+2D(g)达到平衡状态的是
2C(g)+2D(g)达到平衡状态的是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 3Z(g)。下列说法不正确的是
3Z(g)。下列说法不正确的是| A.容器内压强不随时间变化而变化 |
| B.某一时刻,容器内各物质的浓度有可能相等 |
| C.达到平衡时,单位时间内生成3n mol Z,同时生成 2n mol Y |
| D.X,Y的转化率相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO2(g)+O2(g) 平衡时,容器内有0.6 molSO2,其平衡常数约是
2SO2(g)+O2(g) 平衡时,容器内有0.6 molSO2,其平衡常数约是| A.0.68 | B.0.34 | C.0.45 | D.0.47 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 6 H2O + 5N2,当各物质的浓度不随时间变化时,混合气体的体积为17L,则原混合气体中NO和 NH3的体积之比为
6 H2O + 5N2,当各物质的浓度不随时间变化时,混合气体的体积为17L,则原混合气体中NO和 NH3的体积之比为| A.①④ | B.②③ | C.①② | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 5 kJ/mol
5 kJ/mol | A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 | D.降低温度同时增大压强 |
 。(填序号)
。(填序号)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 c C(g)+d D(g) △H = -Q kJ/mol(Q为正值),达平衡状态后,下列结论中不正确的是
c C(g)+d D(g) △H = -Q kJ/mol(Q为正值),达平衡状态后,下列结论中不正确的是查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
| 时间/s 浓度mol·L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)mol·L-1 | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2)/mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
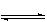 H2+CO2若起始浓度[CO]为2mol/L、[H2O]=
H2+CO2若起始浓度[CO]为2mol/L、[H2O]= 3mol/L,反应达到平衡时,CO的转化率为60%;如果将H2O的起始浓度加大到6mol/L,则CO的转化率为75%。请注意上述有关数据,并总结出规律,完成下列问题:
3mol/L,反应达到平衡时,CO的转化率为60%;如果将H2O的起始浓度加大到6mol/L,则CO的转化率为75%。请注意上述有关数据,并总结出规律,完成下列问题: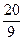 时,b=
时,b= 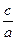 =
= 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com