
有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的
c(Na+)/mol·L-1为 ( )
A.(2y-4x)/a mol·L-1 B. (y-2x)/a mol·L-1
C.(2y-2x)/a mol·L-1 D.(y-x)/a mol·L-1
A
【解析】
试题解析:BaCl2和NaCl的混合溶液a L,将它均分成两份,一份滴加稀硫酸,使Ba2+完全沉淀,消耗xmolH2SO4,
则: SO42- + Ba2+ ═ BaSO4↓
xmol xmol
c(Ba2+)=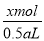 =
=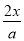 mol/L
mol/L
另一份滴加AgNO3溶液,使Cl-完全沉淀,反应中消耗ymolAgNO3,则:
Ag+ + Cl- = AgCl↓
ymol ymol
c(Cl-)=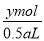 =
=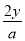 mol/L,
mol/L,
又因为溶液不显电性,设原溶液中的Na+浓度为b,由电荷守恒可知,
b+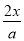 mol/L×2=
mol/L×2=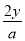 mol/L,b=
mol/L,b=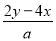 mol/L,
mol/L,
考点:离子方程式的有关计算


科目:高中化学 来源:2014-2015学年湖南益阳市高二上学期10月月考化学试卷(解析版) 题型:填空题
(6分)某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间连线代表单键、双键等化学键)。
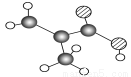
(1)该物质的结构简式为______________________________________________。
(2)下列物质中,与该产品互为同系物的是(填序号)________,互为同分异构体的是__________。
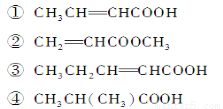
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南益阳市高二上学期10月月考化学试卷(解析版) 题型:选择题
制取一氯乙烷,采用的最佳方法是
A.乙烷和氯气取代反应 B.乙烯和氯气加成反应
C.乙烷和HCl作用 D.乙烯和HCl加成反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南益阳市高一上学期10月月考化学试卷(解析版) 题型:填空题
(14分)下图是我校实验室化学试剂浓硫酸试剂标签上的部分内容。
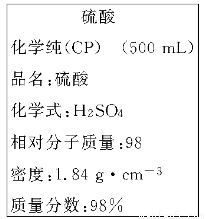
现用该浓硫酸配制480 mL 1 mol·L-1的稀硫酸。可供选用的仪器有:
①胶头滴管;②玻璃棒;③烧杯;④量筒。
请回答下列问题:
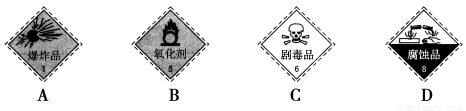
(1)盛放浓硫酸的试剂瓶标签上应印有下列警示标记中的________;
(2)配制稀硫酸时,还缺少的仪器有_________________(写仪器名称)。
(3)经计算,所需浓硫酸的体积约为________mL;若将该硫酸与等体积的水混合,所得溶液中溶质的质量分数____49%(填“>” 、“<” 或“=”)。
(4)配制过程中需先在烧杯中将浓硫酸进行稀释。稀释的操作方法是
_____________________________________________________ ;
若在稀释过程中,少量浓硫酸不慎沾在手上,处理方法为____________。
(5)对所配制的稀硫酸进行测定,发现其浓度大于1 mol·L-1,配制过程中下列各项操作可能引起该误差的原因________。
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③将稀释后的稀硫酸立即转入容量瓶后,立即进行后面的实验操作
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥定容后,把容量瓶倒置摇匀,正放后发现液面低于刻度线,又补充几滴水至刻度处
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南益阳市高一上学期10月月考化学试卷(解析版) 题型:选择题
鉴别SO42-时所选用的试剂及顺序最合理的是( )
A.稀盐酸、BaCl2溶液 B.稀硝酸、BaCl2溶液
C.Ba(NO3)2溶液、稀盐酸 D.BaCl2溶液、稀盐酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北鄂州市高二上第一次月考化学试卷(解析版) 题型:填空题
(1)中和热的测定是高中化学的定量实验之一.50 mL0.50 mol/L 盐酸与50 mL 0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。从实验装置上看,图中尚缺少的一种仪器是 。大烧杯上如不盖硬纸板,求得的中和热数值将会 (填“偏大”、“偏小”或“无影响”)。

(2)氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照下表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是________。同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分 解。为了达到实验目的,你对原实验方案的改进方法是 ________(填一种即可)。
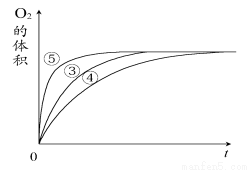
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系下图所示。分析该图能够得出的实验结论是________。
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图所示的实验装置进行实验。
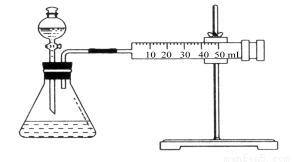
(1)
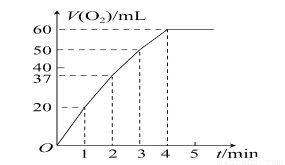
 某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量 ____ 或 _____来比较; (2)0.1g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。解释反应速率变化的原因:________,计算H2O2的初始物质的量浓度为________。(保留两位有效数字,在标准状况下测定)
某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量 ____ 或 _____来比较; (2)0.1g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。解释反应速率变化的原因:________,计算H2O2的初始物质的量浓度为________。(保留两位有效数字,在标准状况下测定)
Ⅲ.(1)为了加深对影响反应速率因素的认识,老师让甲同学完成下列实验:在Ⅱ中的实验装置的锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol/L的硫酸,10s时收集产生的H2体积为50 mL(若折合成标准状况下的H2体积为44.8mL),用锌粒来表示10s内该反应的速率为____g/s;
(2)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是________(填序号)。
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高原料转化率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北鄂州市高二上第一次月考化学试卷(解析版) 题型:选择题
某有机物的结构为下图所示,这种有机物不可能具有的性质是( )

①可以燃烧; ②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应; ④能发生酯化反应;
⑤能发生加聚反应; ⑥能发生水解反应
A.①④ B.只有⑥ C.只有⑤ D.④⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省高一上学期期中化学试卷(解析版) 题型:选择题
已知反应①2BrO3- + Cl2 = Br2 +2ClO3- ②5Cl2 + I2 + 6H2O = 2HIO3 + 10HCl
③ClO3- + 5Cl- + 6H+ = 3Cl2 + 3H2O,下列粒子氧化能力强弱顺序正确的是
A.ClO3->BrO3->IO3->Cl2
B.BrO3- >Cl2>C1O3->IO3-
C.BrO3->ClO3->Cl2>IO3-
D.Cl2>BrO3->C1O3->IO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com