
【题目】(1)写出下列盐水解的离子方程式:
NaClO________________。
(NH4)2SO4________________。
Na2SO3 ________________。
AlCl3________________。
(2)25 ℃,将0.2 mol·L-1 HA溶液与0.2 mol·L-1 NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-),则:(下列空白填“>”“<”或“=”)
①混合溶液中,c(HA)________c(A-)。水电离产生的c(OH-) _____ 10-7 mol·L-1
②混合溶液中,c(HA)+c(A-)________0.1 mol·L-1。
③混合溶液中,由水电离出的c(OH-)___原0.2 mol·L-1 HA溶液中由水电离出的c(H+)。
④25 ℃时,如果取0.2 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合溶液的pH<7,则HA的电离程度______NaA的水解程度。
【答案】ClO- + H2O ![]() HClO + OH- NH4+ + H2O
HClO + OH- NH4+ + H2O ![]() NH3·H2O + H+SO32-+ H2O
NH3·H2O + H+SO32-+ H2O ![]() HSO3- + OH- HSO3- + H2O
HSO3- + OH- HSO3- + H2O ![]() H2SO3+ OH-Al3+ + 3H2O
H2SO3+ OH-Al3+ + 3H2O ![]() Al(OH)3 + 3H+ <>= >>
Al(OH)3 + 3H+ <>= >>
【解析】
(1)次氯酸钠溶液中,次氯酸根离子是弱根离子,水解生成次氯酸和氢氧根离子,水解方程式为ClO-+H2OHClO+OH-;
硫酸铵溶液中,铵根离子是弱碱的阳离子,水解生成一水合氨和氢离子,水解方程式为NH4+ + H2O ![]() NH3·H2O + H+;
NH3·H2O + H+;
亚硫酸钠溶液中,亚硫酸根离子是弱酸根离子,多元弱酸根离子分步水解,亚硫酸根离子第一步水解生成亚硫酸氢根离子和氢氧根离子,水解方程式为SO32-+ H2O ![]() HSO3- + OH-;第二步水解生成亚硫酸和氢氧根离子,水解方程式为HSO3- + H2O
HSO3- + OH-;第二步水解生成亚硫酸和氢氧根离子,水解方程式为HSO3- + H2O ![]() H2SO3+ OH-;
H2SO3+ OH-;
氯化铝溶液中,铝离子是弱碱的阳离子,水解生成氢氧化铝和氢离子,水解方程式为Al3+ + 3H2O ![]() Al(OH)3 + 3H+;
Al(OH)3 + 3H+;
(2)25 ℃,将0.2 mol·L-1 HA溶液与0.2 mol·L-1 NaOH溶液等体积混合,完全反应所得溶液为NaA盐溶液,测得混合溶液中c(Na+)>c(A-),说明HA为弱酸,盐的水解是微弱的。
① 混合溶液为NaA盐溶液,盐的水解是微弱的,故c(HA) <c(A-),盐酸水解促进水的电离,故水电离产生的c(OH-)>10-7 mol·L-1;
② 根据物料守恒,混合溶液中,c(HA)+c(A-)= c(Na+)=![]() =0.1 mol·L-1;
=0.1 mol·L-1;
③ 盐的水解促进水的电离,酸溶液抑制水的电离,故混合溶液中,由水电离出的c(OH-)>原0.2 mol·L-1 HA溶液中由水电离出的c(H+);
④25 ℃时,如果取0.2 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,所得溶液为HA与NaA按1:1形成的溶液,测得混合溶液的pH<7,故HA的电离程度>NaA的水解程度。


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】香豆素类化合物M具有抗病毒、抗癌等多种生物活性。下图是M和聚合物E的合成路线。
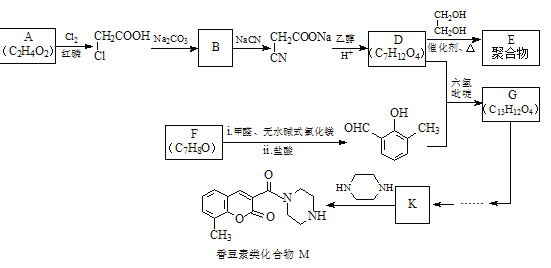
已知:
① ![]()
② ![]()
③ 
(1)A中官能团是_______。
(2)B→![]() 的反应类型是________。
的反应类型是________。
(3)化合物F能与FeCl3溶液发生显色反应,其结构简式是________。F有多种同分异构体,其中属于芳香族化合物、且为醇类物质的结构简式是________。
(4)G的结构简式是________。
(5)D→聚合物E的化学方程式是________。
(6)已知![]() ,将下列G→K的流程图补充完整:_____________________
,将下列G→K的流程图补充完整:_____________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1L密闭容器中有0.1molSO2和0.05molO2发生反应,恒温下30min后达到平衡。
(1)若得到0.06molSO3,求达到平衡时SO2的浓度_______。
(2)求30min内的反应速率:v(SO3)、v(O2)_______。
(3)求平衡时气体压强与开始时气体压强之比_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )
A. 常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降
B. 常温下,c(NH4+)相等的①(NH4)2SO4②(NH4)2Fe(SO4)2③NH4Cl④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③
C. pH相等的CH3COONa、NaHCO3和Na2CO3三种溶液:c(CH3COONa)<c(NaHCO3) <c(Na2CO3)
D. 某温度时水的离子积常数KW=10-13若将此温度下pH=11的NaOH溶液aL与pH=1的稀硫酸bL混合,若所得混合液PH=2,则a:b=2:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作:①过滤;②取固体试剂;③蒸发;④取液体试剂;⑤溶解。一定要 用到玻璃棒的是( )。
A. ①③⑤ B. ②③④ C. ①③④ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种药物在临床上有许多的应用,具有去热、镇痛等疗效,以下是该药物的合成路线。

(1)化合物C的分子式为___________,B中含氧官能团的名称___________。
(2)F→G的反应类型为______________________。
(3)写出D→F的化学方程式____________________________________________。
(4)F的同分异构体有多种,符合以下条件的同分异构体有___________种,写出其中一种同分异构体的结构简式______________________。
①属于芳香族化合物,苯环上只有两个支链,苯环上的一氯代物只有两种。
②能与FeCl3溶液发生显色反应。
③能与碳酸氢钠反应产生气体。
(5)写出由2—溴丁烷、丙烯酸和乙醇为原料合成![]() 的合成路线(其他试剂任选)。
的合成路线(其他试剂任选)。
_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫元素的几种化合物存在下列转化关系:
![]()
下列判断不正确的是
A. 反应①中浓硫酸作氧化剂 B. 反应②表明SO2有酸性氧化物的性质
C. 反应③的原子利用率是100% D. 反应④稀H2SO4作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源,CH4—H2O催化重整是目前大规模制取氢气的重要方法。
(1)CH4-H2O催化重整:
反应Ⅰ:CH4(g)+H2O(g)![]() CO(g)+3H2(g) H1 = +210kJ/mol
CO(g)+3H2(g) H1 = +210kJ/mol
反应Ⅱ: CO(g)+ H2O(g)![]() CO2(g)+H2(g) H2 =﹣41kJ/mol
CO2(g)+H2(g) H2 =﹣41kJ/mol
①提高CH4平衡转化率的条件是________。
a.增大压强 b.加入催化剂 c.增大水蒸气浓度
②CH4、H2O催化重整生成CO2、H2的热化学方程式是________。
③在密闭容器中,将2.0 mol CO与8.0 mol H2O混合加热到800℃发生反应Ⅱ,达到平衡时CO的转化率是80%,其平衡常数为 _________。
(2)实验发现,其他条件不变,相同时间内,向催化重整体系中投入一定量的CaO可以明显提高H2的百分含量。做对比实验,结果如下图所示:

①投入CaO时,H2百分含量增大的原因是:_________。
②投入纳米CaO时,H2百分含量增大的原因是:__________。
(3)反应中催化剂活性会因积炭反应而降低,相关数据如下表:
反应 | Ⅰ | Ⅱ |
|
| |
H(kJ/mol) | +75 | ﹣173 |
①研究发现,如果反应Ⅰ不发生积炭过程,则反应Ⅱ也不会发生积炭过程。因此,若保持催化剂的活性,应采取的条件是_________。
②如果Ⅰ、Ⅱ均发生了积炭反应,通入过量水蒸气能有效清除积炭,反应的化学方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过所学知识,回答下面问题
(1)写出铁与水蒸气在高温下反应方程式_______________________________________。
(2)加热碳酸氢钠的化学方程式为______________________________________
(3)在呼吸面具中,Na2O2起反应的化学方程式为__________________。当有7.8克Na2O2反应时,放出氧气的质量为__________。
(4)将铜片投入到FeCl3溶液中恰好完全反应,发生的反应离子方程式为___________。
(5)向FeSO4溶液中滴加NaOH溶液时,生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色。写出此变化过程的化学方程式: __________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com