
【题目】(1)化合物![]() 的相对分子质量为86,所含碳的质量分数为
的相对分子质量为86,所含碳的质量分数为![]() ,氢的质量分数为
,氢的质量分数为![]() ,其余为氧。
,其余为氧。
①![]() 的分子式为______。
的分子式为______。
②![]() 有多种同分异构体,写出五个同时满足下列条件的同分异构体的结构简式:______、______、______、______、______。
有多种同分异构体,写出五个同时满足下列条件的同分异构体的结构简式:______、______、______、______、______。
(i)含有酯基(ii)能使溴的四氯化碳溶液褪色
(2)烃基烯基醚(![]() )
)![]() 的相对分子质量为176,其分子中碳氢原子个数比为
的相对分子质量为176,其分子中碳氢原子个数比为![]() ,则
,则![]() 的分子式为______。
的分子式为______。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】700℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是
A. 反应在t1 min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40mol
C. 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D. 温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSO4溶液放置在空气中容易变质,因此为了方便使用Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)26H2O],它比绿矾或绿矾溶液更稳定。
I.某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都经过煮沸、冷却后再使用。向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作_______、冷却结晶、过滤、洗涤和干燥后得到一种浅蓝绿色的晶体。
II.实验探究影响溶液中Fe2+稳定性的因素
(1)配制0.8 mol/L的FeSO4溶液(pH=4.5)和0.8 mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2 mL上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,15min后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
(资料1)
沉淀 | Fe(OH)2 | Fe(OH)3 |
开始沉淀 pH | 7.6 | 2.7 |
完全沉淀 pH | 9.6 | 3.7 |
①请用离子方程式解释FeSO4溶液产生淡黄色浑浊的原因___________________。
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其他条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其他条件相同时,在一定 pH范围内,溶液 pH越小Fe2+稳定性越好。
假设3:__________________________________________________。
(2)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分别控制溶液A(0.2 mol/L NaCl)和溶液B(0.1mol/L FeSO4)为不同的 pH,观察记录电流计读数,对假设2进行实验研究,实验结果如下表所示。
序号 | A 0.2mol/LNaCl | B 0.1mol/LFeSO4 | 电流计读数 |
实验1 | pH=1 | pH=5 | 8.4 |
实验2 | pH=1 | pH=1 | 6.5 |
实验3 | pH=6 | pH=5 | 7.8 |
实验4 | pH=6 | pH=1 | 5.5 |
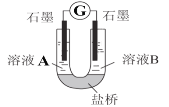
(资料2)原电池装置中,其他条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大。
(资料3)常温下,0.1mol/LpH=1的FeSO4溶液比pH=5的FeSO4溶液稳定性更好。
根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U型管中左池的电极反应式_________________。
②对比实验1和2(或3和4),在一定pH范围内,可得出的结论为______ 。
③对比实验_____和_____ 还可得出在一定 pH范围内,溶液酸碱性变化是对O2氧化性强弱的影响因素。
④对(资料3)实验事实的解释为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚苯乙烯的结构简式为 ,试回答下列问题:
,试回答下列问题:
(1)聚苯乙烯的分子式为__________,链节是____________,单体是_________________。
(2)实验测得聚苯乙烯的相对分子质量(平均值)为52000,则该高聚物的聚合度![]() 为________。
为________。
(3)一定条件下合成聚苯乙烯的化学方程式为______,该反应类型为_______反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某中草药提取的有机物结构如图所示,该有机物的下列说法中错误的是( )
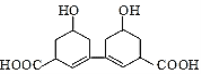
A.分子式为C14H18O6
B.1mol该有机物最多可与2mol的H2发生加成反应
C.既可以与FeCl3溶液发生显色反应,又可以与Na2CO3溶液反应
D.1mol该有机物最多可反应2mol氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法不正确的是( )
A.用来制造电线电缆的聚乙烯树脂属于热塑性高分子材料
B.研发可降解高分子材料,可以减少“白色污染”
C.棉、麻、羊毛及合成纤维完全燃烧都只生成![]() 和
和![]()
D.硅橡胶![]() 可由
可由![]() 经水解、缩聚两步反应制得
经水解、缩聚两步反应制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃分子中若含有双键、叁键或环,其碳原子所结合的氢原子则少于同碳原子数对应烷烃所含的氢原子数,亦具有一定的不饱和度![]() 用
用![]() 表示
表示![]() 。下表列出几种烃的不饱和度:
。下表列出几种烃的不饱和度:
有机物 | 乙烯 | 乙炔 | 环己烷 | 苯 |
| 1 | 2 | 1 | 4 |
据此下列说法不正确的是![]()
![]()
A.![]() 的不饱和链烃再结合6molH即达到饱和
的不饱和链烃再结合6molH即达到饱和
B.![]() 的
的![]() 等于6
等于6
C.![]() 与环丁烷的不饱和度相同
与环丁烷的不饱和度相同
D.![]() 的不饱和度与
的不饱和度与![]() 、
、![]() 的不饱和度相同
的不饱和度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SPC(2Na2CO33H2O2)具有Na2CO3和H2O2的双重性质,广泛应用于印染、医药卫生等领域。以芒硝(Na2SO410H2O)、H2O2等为原料制备SPC的工艺流程如下:
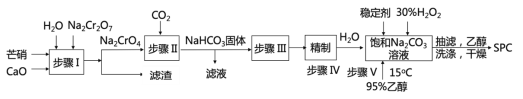
回答下列问题:
(1)步骤I产生的滤渣为__________________(填名称)。
(2)步骤II中发生反应的离子方程式为_________________。其中生成的__________(填化学式)可以循环使用。
(3)步骤V中,合成时需选择温度为15℃,其原因是_____________________。
(4)抽滤后用乙醇洗涤的作用是_______________________________________。
(5)SPC的保存方法是______________________________。
(6)过氧化氢用催化剂催化分解时生成水和氧原子,该氧原子非常活泼,称为活性氧。称量0.1600 g样品,置于250 mL锥形瓶中,并用100 mL 0.5 molL-1硫酸溶解完全,立即用0.02000molL-1KMnO4标准溶液滴定,滴定至终点时溶液颜色为_____,且半分钟内不恢复为原来的颜色,进行三次平行实验,消耗KMnO4溶液的平均体积为26.56 mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗KMnO4溶液的平均体积为2.24 mL。该样品的活性氧含量为______%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.燃烧热的数值都会随反应物的用量不同而改变,故1mol S(s)和2mol S(s)的燃烧热不相等
B.已知:2C(s)+2O2(g)=2CO2(g)ΔH=akJ/mol;2C(s)+2O2(g)=2CO(g)ΔH=bkJ/mol 则a>b
C.H2(g)的燃烧热为285.8kJ/mol,则表示H2燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol
D.反应NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57kJ/mol,在低温条件下不能自发进行,但在高温条件下能自发进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com