
����Ŀ��FeSO4��Һ�����ڿ��������ױ��ʣ����Ϊ�˷���ʹ��Fe2+��ʵ�����г�������������茶���[�׳ơ�Ħ���Ρ�����ѧʽΪ(NH4)2Fe(SO4)26H2O]�������̷����̷���Һ���ȶ���
I��ij��ȤС�����ʵ���Ʊ���������茶��塣
��ʵ���У�������Һ�Լ�����ʹ�õ�������ˮ��������С���ȴ����ʹ�á���FeSO4��Һ�м��뱥��(NH4)2SO4��Һ����������_______����ȴ�ᾧ�����ˡ�ϴ�Ӻ����õ�һ��dz����ɫ�ľ��塣
II��ʵ��̽��Ӱ����Һ��Fe2+�ȶ��Ե�����
(1)����0.8 mol/L��FeSO4��Һ��pH=4.5����0.8 mol/L��(NH4)2Fe(SO4)2��Һ��pH=4.0������ȡ2 mL������Һ����֧�Թ��У��տ�ʼ������Һ����dz��ɫ���ֱ�ͬʱ�μ�2��0.01mol/L��KSCN��Һ��15min��۲�ɼ���(NH4)2Fe(SO4)2��Һ��ȻΪdz��ɫ��������Һ��FeSO4��Һ����ֵ���ɫ���ǡ�
������1��
���� | Fe(OH)2 | Fe(OH)3 |
��ʼ���� pH | 7.6 | 2.7 |
��ȫ���� pH | 9.6 | 3.7 |
���������ӷ���ʽ����FeSO4��Һ��������ɫ���ǵ�ԭ��___________________��
������Ӱ��Fe2+�ȶ��Ե����أ�С��ͬѧ�������3�ּ��裺
����1������������ͬʱ��NH4+�Ĵ���ʹ(NH4)2Fe(SO4)2��Һ��Fe2+�ȶ��ԽϺá�
����2������������ͬʱ����һ�� pH��Χ�ڣ���Һ pHԽСFe2+�ȶ���Խ�á�
����3��__________________________________________________��
(2)С��ͬѧ����ͼװ�ã�GΪ���������ƣ�������������������Һ�ֱ������ҺA��0.2 mol/L NaCl������ҺB��0.1mol/L FeSO4��Ϊ��ͬ�� pH���۲��¼�����ƶ������Լ���2����ʵ���о���ʵ�������±���ʾ��
��� | A 0.2mol/LNaCl | B 0.1mol/LFeSO4 | �����ƶ��� |
ʵ��1 | pH=1 | pH=5 | 8.4 |
ʵ��2 | pH=1 | pH=1 | 6.5 |
ʵ��3 | pH=6 | pH=5 | 7.8 |
ʵ��4 | pH=6 | pH=1 | 5.5 |
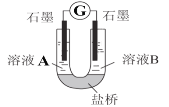
������2��ԭ���װ���У�����������ͬʱ��������Ӧ��Ļ�ԭ��Խǿ��������Ӧ���������Խǿ����ԭ��صĵ���Խ��
������3�������£�0.1mol/LpH=1��FeSO4��Һ��pH=5��FeSO4��Һ�ȶ��Ը��á�
��������ʵ������������Ϣ����С�����ۿ��Եó����½��ۣ�
��U������صĵ缫��Ӧʽ_________________��
�ڶԱ�ʵ��1��2����3��4������һ��pH��Χ�ڣ��ɵó��Ľ���Ϊ______ ��
�۶Ա�ʵ��_____��_____ ���ɵó���һ�� pH��Χ�ڣ���Һ����Ա仯�Ƕ�O2������ǿ����Ӱ�����ء�
�ܶԣ�����3��ʵ����ʵ�Ľ���Ϊ____________________��
���𰸡�����Ũ�� 4Fe2+ + O2 + 10H2O��4Fe(OH)3�� + 8H+ ������������ͬʱ�����������Ũ�ȴ�СӰ��Fe2+���ȶ��ԣ�������������ͬʱ�����������Ũ��Խ��Fe2+���ȶ��ԽϺá��� O2 + 4e- +4H+��2H2O ��Һ����Խǿ��Fe2+�Ļ�ԭ��Խ�� 1 3����2��4�� ����������ͬʱ����Һ������ǿ��Fe2+�Ļ�ԭ�Լ�����Ӱ�죬�����˶�O2����������ǿ��Ӱ�죬��pH=1��FeSO4��Һ���ȶ�������������������֣�
��������
�����������ʼ�ʵ��������������Ļ�ѧ��Ӧ������������Һ����Ũ�ȵIJ����жϣ�NH4+��SO42-�Լ�H+����Ӱ��Fe2+�ȶ��ԣ��ɱ������ݿ�֪����Һ����Խǿ�������ƶ���ԽС��˵��Fe2+�Ļ�ԭ��Խ������ʵ��1��3����2��4����֪��pHԽ������ƶ���ԽС���Դ˽����⡣
I��FeSO4���л�ԭ�ԣ�Ӧ���ⱻ������������ˮ��������С���ȴ����ʹ�ã���ȥˮ���ܽ������������Һ�õ����壬Ӧ�ȼ���Ũ����Һ��Ȼ����ȴ�ᾧ�����ˡ�ϴ�Ӻ���ʴ�Ϊ������Ũ����
II����1����FeSO4��Һ���ֵ���ɫ���ǣ�Ӧ���������������������ӷ���ʽΪ4Fe2++O2+10H2O=4Fe��OH��3��+8H+���ʴ�Ϊ��4Fe2++O2+10H2O=4Fe��OH��3��+8H+��
�ڸ���������Һ����Ũ�ȵIJ����жϣ�NH4+��SO42-�Լ�H+����Ӱ��Fe2+�ȶ��ԣ��������Ϣ��֪������3��Ϊ������������ͬʱ�����������Ũ�ȴ�СӰ��Fe2+���ȶ��ԣ�������������ͬʱ�����������Ũ��Խ��Fe2+���ȶ��ԽϺã����ʴ�Ϊ��������������ͬʱ�����������Ũ�ȴ�СӰ��Fe2+���ȶ��ԣ�������������ͬʱ�����������Ũ��Խ��Fe2+���ȶ��ԽϺã���
��2����AΪ�Ȼ�����Һ����������������������Ӧ���缫����ʽΪO2+4e-+4H+=2H2O���ʴ�Ϊ��O2+4e-+4H+=2H2O��
���ɱ������ݿ�֪����Һ����Խǿ�������ƶ���ԽС��˵��Fe2+�Ļ�ԭ��Խ�����ʴ�Ϊ����Һ����Խǿ��Fe2+�Ļ�ԭ��Խ����
����ʵ��1��3����2��4����֪��pHԽ������ƶ���ԽС���ɵó���һ��pH��Χ�ڣ���Һ����Ա仯��O2������ǿ����Ӱ�����أ��ʴ�Ϊ��1��3����2��4����
���ɱ������ݿ�֪��pH�仯���������ӵĻ�ԭ�Խ�ǿ�������ƶ�������ϴ�֪����������ͬʱ����Һ������ǿ��Fe2+�Ļ�ԭ�Լ�����Ӱ�죬�����˶�O2����������ǿ��Ӱ�졣��pH=1��FeSO4��Һ���ȶ����ʴ�Ϊ������������ͬʱ����Һ������ǿ��Fe2+�Ļ�ԭ�Լ�����Ӱ�죬�����˶�O2����������ǿ��Ӱ�죬��pH=1��FeSO4��Һ���ȶ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ�������
����״���£�1 L HCl��1 L H2O�����ʵ�����ͬ
����״���£�1 g H2��14 g N2�������ͬ
��28 g CO�����Ϊ22.4 L
���������ʵ����ʵ�����ͬ���������ڱ�״���µ����Ҳ��ͬ
��ͬ��ͬ����£���������ʵ���Խ����ѹǿԽ��
��ͬ��ͬѹ�£�������ܶ����������Է�������������
A.�٢ڢ�B.�ڢݢ�C.�ڢۢ�D.�ܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ԫ��Qλ��ds�����������Ӱ����;������Ԫ��W��X��Y��Z��һ��������ԭ�������Ĺ�ϵ��ͼ��ʾ����ش���������(��Q��W��X��Y��Z����Ӧ��Ԫ�ط�������)��
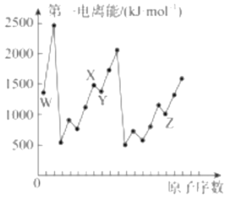
��1��X��W��ɵ�һ�ֶ�Ԫ�����ﳣ�������ȼ�ϣ��û�������Xԭ�ӵ��ӻ���ʽΪ___________��
��2��X2Y�����������������������ȵ�����ԭ����Ԥ��X2Y�Ŀռ乹��Ϊ______________��
��3��Q��X�γɵ�һ�ֶ�Ԫ����������������ṹ��ͼ��ʾ��
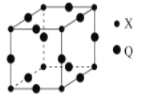
Qԭ����Χ������������Qԭ�ӵ���ĿΪ_______�����������ֱ�ʾ����
��4����֪����Q����Ķѻ���ʽΪ�����������ܶѻ�������Q����ľ�����ԭ�ӵĿռ�������Ϊ_________________(�ú�����ʽ�ӱ�ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���SiO2����˵����ȷ����( )
A.SiO2���ɼ��Լ����ɵķǼ��Է���
B.��NA��ʾ�����ӵ����������³�ѹ��60g SiO2�к��еĹ��ۼ���ĿΪ2NA
C.̼��ͬ���壬���CO2��SiO2��ѧ�������ƣ���������Ҳ����
D.SiO2����ṹ�е���С��Ϊ6��Si��6��O��ɵ�12Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ���ϳɷ�Ӧ������ͼ��

��1����д���м����A��B��C�Ľṹ��ʽ��
A.______________��B.______________��C.______________��
��2��д���٢ڢܸۢ�����Ӧ����ķ�Ӧ�Լ���������Ӧ�������͡�
��______________��______________��
��______________��______________��
��______________��______________��
��______________��______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�������һ�������£����ܷ�����ȥ��Ӧ�����ܷ���ˮ�ⷴӦ���ǣ� ��
A.CH3ClB.![]()
C.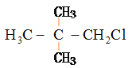 D.
D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����кϳ��л��߷��Ӳ��ϵĻ�ѧ����ʽ�ͷ�Ӧ���Ͷ���ȷ����( )
A.nCH2=CH-CN![]()
![]() �Ӿ۷�Ӧ
�Ӿ۷�Ӧ
B.![]() ���۷�Ӧ
���۷�Ӧ
C.nCH2=CH2+nCH2=CH-CH3![]()
![]() ���۷�Ӧ
���۷�Ӧ
D.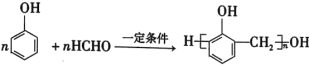 ���۷�Ӧ
���۷�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��������![]() ����Է�������Ϊ86������̼����������Ϊ
����Է�������Ϊ86������̼����������Ϊ![]() �������������Ϊ
�������������Ϊ![]() ������Ϊ����
����������
��![]() �ķ���ʽΪ______��
�ķ���ʽΪ______��
��![]() �ж���ͬ���칹�壬д�����ͬʱ��������������ͬ���칹��Ľṹ��ʽ��______��______��______��______��______��
�ж���ͬ���칹�壬д�����ͬʱ��������������ͬ���칹��Ľṹ��ʽ��______��______��______��______��______��
��i������������ii����ʹ������Ȼ�̼��Һ��ɫ
��2������ϩ���ѣ�![]() ��
��![]() ����Է�������Ϊ176���������̼��ԭ�Ӹ�����Ϊ
����Է�������Ϊ176���������̼��ԭ�Ӹ�����Ϊ![]() ����
����![]() �ķ���ʽΪ______��
�ķ���ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���������������ϵ���ܡ�����˵����ȷ����( )
A.����ɫ��Ⱦ����ָ����ϩ���۱�ϩ��������Ⱦ�����ǵķ����ڲ�������˫��
B.�۱�ϩ������Ϳ��(![]() )��Ŀǰ���е�ǽ��Ϳ��֮һ������ͨ�����۷�Ӧ�γɵ�
)��Ŀǰ���е�ǽ��Ϳ��֮һ������ͨ�����۷�Ӧ�γɵ�
C.��������������������ٲ��Ͽ����Ǿ������۰�����
D.����������ľ�����ά�����ڹ���ͨ�ŵĹ��ά�����������л��߷��Ӳ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com