
【题目】下面是一个合成反应的流程图:

(1)请写出中间产物A、B、C的结构简式:
A.______________,B.______________,C.______________。
(2)写出①②③④各步反应所需的反应试剂及各步反应所属类型。
①______________,______________;
②______________,______________;
③______________,______________;
④______________,______________;
【答案】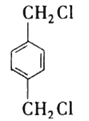
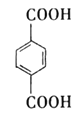
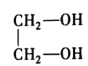 NaOH水溶液 水解(取代)反应 O2 氧化反应 Br2的CCl4溶液 加成反应 浓硫酸 酯化(取代)反应
NaOH水溶液 水解(取代)反应 O2 氧化反应 Br2的CCl4溶液 加成反应 浓硫酸 酯化(取代)反应
【解析】
对二甲苯在光照下取代生成A: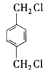 ,A进行取代,羟基取代卤素原子,生成醇,醇进行连续氧化,最终变成酸(B)
,A进行取代,羟基取代卤素原子,生成醇,醇进行连续氧化,最终变成酸(B)![]() ;乙烯进行加成生成二溴乙烷,卤代烃再发生水解反应生成C:
;乙烯进行加成生成二溴乙烷,卤代烃再发生水解反应生成C: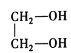 ,BC结合发生酯化反应。
,BC结合发生酯化反应。
(1)根据分析可知,中间产物A、B、C的结构简式分别为: 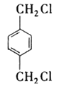 ;
;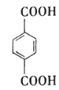 ;
; 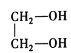 ;
;
(2) 反应①是卤代烃的水解反应,需要试剂为:NaOH水溶液,反应类型是取代反应;
反应②是醇氧化为醛,试剂是O2,反应类型为氧化反应;
反应③是乙烯的加成反应,试剂是Br2的CCl4溶液,反应类型为加成反应;
反应④是酸和醇的酯化反应,反应条件是浓硫酸、加热,反应类型为酯化反应(取代反应)。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】CH3CH2OH和 ![]() 互为同分异构体,将两种物质分别放在下列检测仪上进行检测,显示出的信号完全相同的是
互为同分异构体,将两种物质分别放在下列检测仪上进行检测,显示出的信号完全相同的是
A.李比希元素分析仪B.红外光谱仪C.核磁共振仪D.质谱仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是

A. 催化剂a表面发生了极性共价键的断裂和形成
B. N2与H2反应生成NH3的原子利用率为100%
C. 在催化剂b表面形成氮氧键时,不涉及电子转移
D. 催化剂a、b能提高反应的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10 mL0.1 mol/L的HR溶液中逐滴加入0.1 mol/L的氨水,所得溶液pH及导电能力变化如图。下列分析正确的是( )
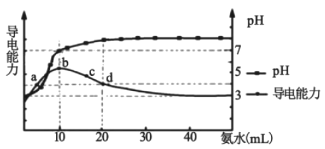
A. 各点溶液中的阳离子浓度总和大小关系:d>c>b>a
B. 常温下,R- 的水解平衡常数数量级为10 -9
C. a点和d点溶液中,水的电离程度相等
D. d点的溶液中,微粒浓度关系:c(R-)+2c(HR)=c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在金属或非金属底物材料上,用NaBH4进行“化学镀”镀镍,可以得到坚硬、耐腐蚀的保护层(3Ni3B+Ni),反应的离子方程式为:
20Ni2++16BH4-+34OH-+6H2O===2(3 Ni3B+ Ni)+10B(OH)4-+35H2![]()
(1)Ni2+基态核外电子排布式为________。
(2)与BH4-互为等电子体的一种分子为______________![]() 填化学式
填化学式![]() 。
。
(3)B(OH)4-中硼原子轨道的杂化类型是________;1mol B(OH)4-含有σ键的数目为________mol。
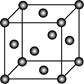
(4)Ni的晶胞结构如图所示,镍晶体中每个镍原子周围距离最近的镍原子数目为________。
(5)NiCl2![]() 6H2O在SOCl2气流中加热时,生成NiCl2和两种酸性气体。写出该反应的化学方程式:__________________。
6H2O在SOCl2气流中加热时,生成NiCl2和两种酸性气体。写出该反应的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSO4溶液放置在空气中容易变质,因此为了方便使用Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)26H2O],它比绿矾或绿矾溶液更稳定。
I.某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都经过煮沸、冷却后再使用。向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作_______、冷却结晶、过滤、洗涤和干燥后得到一种浅蓝绿色的晶体。
II.实验探究影响溶液中Fe2+稳定性的因素
(1)配制0.8 mol/L的FeSO4溶液(pH=4.5)和0.8 mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2 mL上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,15min后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
(资料1)
沉淀 | Fe(OH)2 | Fe(OH)3 |
开始沉淀 pH | 7.6 | 2.7 |
完全沉淀 pH | 9.6 | 3.7 |
①请用离子方程式解释FeSO4溶液产生淡黄色浑浊的原因___________________。
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其他条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其他条件相同时,在一定 pH范围内,溶液 pH越小Fe2+稳定性越好。
假设3:__________________________________________________。
(2)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分别控制溶液A(0.2 mol/L NaCl)和溶液B(0.1mol/L FeSO4)为不同的 pH,观察记录电流计读数,对假设2进行实验研究,实验结果如下表所示。
序号 | A 0.2mol/LNaCl | B 0.1mol/LFeSO4 | 电流计读数 |
实验1 | pH=1 | pH=5 | 8.4 |
实验2 | pH=1 | pH=1 | 6.5 |
实验3 | pH=6 | pH=5 | 7.8 |
实验4 | pH=6 | pH=1 | 5.5 |
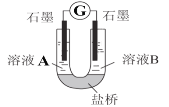
(资料2)原电池装置中,其他条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大。
(资料3)常温下,0.1mol/LpH=1的FeSO4溶液比pH=5的FeSO4溶液稳定性更好。
根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U型管中左池的电极反应式_________________。
②对比实验1和2(或3和4),在一定pH范围内,可得出的结论为______ 。
③对比实验_____和_____ 还可得出在一定 pH范围内,溶液酸碱性变化是对O2氧化性强弱的影响因素。
④对(资料3)实验事实的解释为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1,2-二氯乙烷在常温下为无色液体,沸点为83.5 ℃,密度为1.23 g·mL-1,难溶于水,易溶于醇、醚、丙酮等有机溶剂;乙醇的沸点为78.5 ℃。某化学课外活动小组为探究1,2-二氯乙烷的消去反应,设计了如图所示的实验装置。请回答下列问题:

(1)为了检查整套装置的气密性,某同学将导气管末端插入盛有水的烧杯中,用双手捂着装置A中大试管,但该方法并不能准确说明装置的气密性是否良好。则正确检查整套装置气密性的方法是_______________。
(2)向装置A中大试管里先加入1,2-二氯乙烷和NaOH的乙醇溶液,再加入______,目的是______,并向装置C中试管里加入适量稀溴水。
(3)为了使反应在75 ℃左右进行,常用的方法是_______________________________。
(4)与装置A中大试管相连接的长玻璃管的作用是______,装置B的作用是______。
(5)能证明1,2-二氯乙烷已发生消去反应的实验现象是______,装置A、C中发生反应的化学方程式分别为_________________________;________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某中草药提取的有机物结构如图所示,该有机物的下列说法中错误的是( )
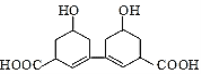
A.分子式为C14H18O6
B.1mol该有机物最多可与2mol的H2发生加成反应
C.既可以与FeCl3溶液发生显色反应,又可以与Na2CO3溶液反应
D.1mol该有机物最多可反应2mol氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、R是短周期原子序数依次增大的主族元素,X原子最外层电子数是电子层数的2倍,Z为地壳中含量最高的元素,R的单质是短周期最活泼的金属。由W、X、Y三种元素组成的化合物甲的球棍模型如图,甲是运载火箭的燃料之一。下列说法正确的是
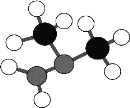
A.化合物甲分子中每个原子都达8电子的稳定结构
B.W、Y、Z三种元素可形成离子化合物
C.Y与Z只能形成2种二元化合物
D.简单离子半径:R > Z > Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com