
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是

A. 催化剂a表面发生了极性共价键的断裂和形成
B. N2与H2反应生成NH3的原子利用率为100%
C. 在催化剂b表面形成氮氧键时,不涉及电子转移
D. 催化剂a、b能提高反应的平衡转化率
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.C4H10的一氯代物有2种
B.正戊烷分子中所有的碳原子均在同一条直线上
C.可用溴水来除去甲烷中混有的少量乙烯
D.某烃的分子式为C3H6,符合通式CnH2n,故该分子一定属于烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用图1装置(夹持仪器已省略)制备溴苯,并探究该反应原理。
Ⅰ.制备溴苯
(1)装置中长导管a的作用是__________、导出气体。
(2)本实验所获得的溴苯为褐色,是因为_________.
Ⅱ.分离提纯
已知,溴苯与苯互溶,液溴、苯、溴苯的沸点依次为59℃、80℃、156℃。同学们设计了如图2流程:
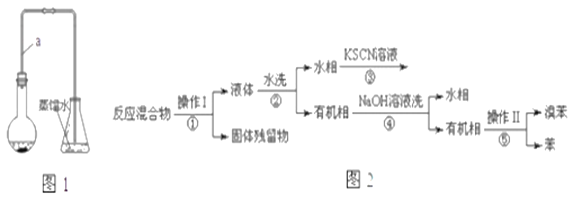
(3)操作Ⅱ为________.
(4)流程②和④中,需要用到的玻璃仪器是烧杯、___;流程③的现象为____,流程④的作用是_____.
Ⅲ.探究原理
(5)反应结束后,某同学取少量锥形瓶中的液体于试管中,再滴入几滴AgNO3溶液,出现浅黄色浑浊,从而判断反应一定生成了HBr,你认为该同学的判断________(填“合理”、“不合理”)。
(6)为探究锥形瓶中溶液的离子,请完成如表探究实验方案(限选试剂:镁粉、四氯化碳、氯水、溴水、蒸馏水)
实验步骤 | 预期现象 | 结论 |
1.将锥形瓶中的液体转入分液漏斗,加足量①__,振荡后分液。分别取少量②_层溶液于试管A、B中 | _______ | ______ |
2.向试管A中加入少量③___和四氯化碳,振荡后静置; | 溶液分层,下层显④___色 | 锥形瓶中液体含大量Br |
3.向试管B中加入⑤___. | 有汽泡生成 | 锥形瓶中液体含大量⑥___ |
根据上述结论推断,制备溴苯的反应属于___反应,其反应方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。

(1)写出A中反应的化学方程式_______________。
(2)观察到A中的现象是_____________________。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________,写出有关的化学方程式______________________________。
(4)C中盛放CCl4的作用是________________。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入_______,现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,相同条件下,两个容积相同的试管分别装满NO2和NO气体,分别倒置于水槽中,然后通过导管缓慢通入氧气,边通边慢慢摇动试管,直到两个试管内充满液体。假设试管内的溶质不向水槽中扩散,则两个试管内溶液物质的量浓度之比为
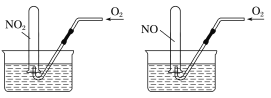
A.1∶1B.5∶7C.7∶5D.4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药麻黄成分中含有生物碱、黄酮、鞣质、挥发油、有机酚、多糖等许多成分,其中一种有机酚的结构简式如图。下列说法正确的是 ( )
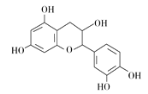
A. 分子中所有碳原子可以处于同一平面
B. 分子式为C15H12O7
C. 1 mol该有机物跟足量浓溴水反应,最多消耗5 mol Br2
D. 1 mol该有机物与NaOH溶液反应最多消耗5 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中指定的比值是2∶1的是 ( )
A. C2H4在氧气中充分燃烧生成的CO2与H2O的物质的量之比
B. K2S溶液中c(K+)与c(S2-)之比
C. Na2O2晶体中阳离子与阴离子的物质的量之比
D. CsCl晶体中阴、阳离子的配位数比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下氨气能被氯气氧化生成N2,化工厂常用此法检验管道是否泄漏氯气。某探究小组在实验室对氨气与氯气反应进行了探究,回答下列问题。
Ⅰ.氨气的制备
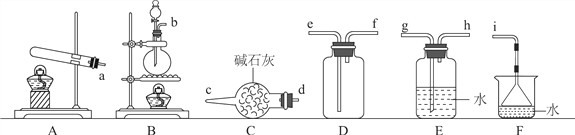
(1)氨气的发生装置可以选择上图中的________(填大写字母),反应的化学方程式为____________________________________。
(2)欲收集一瓶干燥的氨气,选择上图中的装置,按气流方向写出其接口的连接顺序:发生装置管口→________(填小写字母)。
Ⅱ.氯气与氨气的反应
室温下,用收集到的氨气按下图所示装置进行实验(实验前k1、k2关闭)。
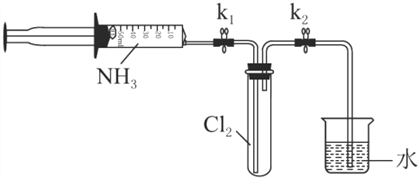
(3)打开k1,缓缓推动注射器活塞,向试管中注入约3倍于氯气体积的氨气,关闭k1,恢复室温。试管中可观察到的现象是________。发生反应的化学方程式为________。
(4)再打开k2,可观察到的现象是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com