
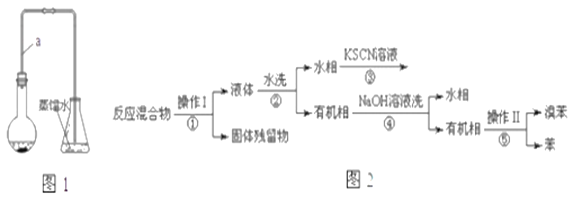
【题目】某小组同学利用图1装置(夹持仪器已省略)制备溴苯,并探究该反应原理。
Ⅰ.制备溴苯
(1)装置中长导管a的作用是__________、导出气体。
(2)本实验所获得的溴苯为褐色,是因为_________.
Ⅱ.分离提纯
已知,溴苯与苯互溶,液溴、苯、溴苯的沸点依次为59℃、80℃、156℃。同学们设计了如图2流程:
(3)操作Ⅱ为________.
(4)流程②和④中,需要用到的玻璃仪器是烧杯、___;流程③的现象为____,流程④的作用是_____.
Ⅲ.探究原理
(5)反应结束后,某同学取少量锥形瓶中的液体于试管中,再滴入几滴AgNO3溶液,出现浅黄色浑浊,从而判断反应一定生成了HBr,你认为该同学的判断________(填“合理”、“不合理”)。
(6)为探究锥形瓶中溶液的离子,请完成如表探究实验方案(限选试剂:镁粉、四氯化碳、氯水、溴水、蒸馏水)
实验步骤 | 预期现象 | 结论 |
1.将锥形瓶中的液体转入分液漏斗,加足量①__,振荡后分液。分别取少量②_层溶液于试管A、B中 | _______ | ______ |
2.向试管A中加入少量③___和四氯化碳,振荡后静置; | 溶液分层,下层显④___色 | 锥形瓶中液体含大量Br |
3.向试管B中加入⑤___. | 有汽泡生成 | 锥形瓶中液体含大量⑥___ |
根据上述结论推断,制备溴苯的反应属于___反应,其反应方程式为______。
【答案】冷凝回流 溴苯中溶有溴而呈褐色 蒸馏 分液漏斗 溶液变红色 除去溴苯中混有的Br2 不合理 四氯化碳 上 氯水 橙红色 镁粉 H+ 取代反应 
【解析】
(1)根据图1,反应为放热反应,长导管让挥发出来溴单质、苯冷凝,提高原料的利用率,即长导管的作用是冷凝回流、导气;
(2)溴苯是无色液体,溴苯中溶有溴而呈褐色;
(3)反应混合物中含有苯、溴苯、溴、FeBr3以及Fe,由流程可知经操作I后得到固体残留物和液体,则操作I为过滤,固体残留物为Fe,液体中含有FeBr3等,水洗后进行分液分离,有机相含有苯、溴苯、溴,加入NaOH溶液除去Br2,再经过分液分离,水相中主要含有NaBr和NaBrO等,有机相中含有苯、溴苯,由于二者沸点不同,进行蒸馏分离,即操作II为蒸馏;
(4)流程②④得到水相和有机相,应为分液,除需要烧杯外,还需要分液漏斗;流程②分液后的水相溶液中含有Fe3+,流程③滴加KSCN溶液,溶液变红色;流程④的作用是除去溴苯中混有的Br2;
(5)由于溴单质易挥发,锥形瓶中有挥发出来的Br2,Br2也能与AgNO3溶液产生浅黄色沉淀,干扰了HBr的检验,因此该同学判断不合理;
(6)为探究锥形瓶中溶液的离子,根据题给试剂,1.使混合液分层,需要加入有机溶剂,则①为四氯化碳,由于四氯化碳的密度大于水,则含有离子的溶液在上层,有机溶剂在下层,应该取上层溶液,即②为上;
2.根据结论“锥形瓶中含大量Br-”,则③为氧化剂,即氯水将Br-氧化成Br2,CCl4将Br2萃取到CCl4层,则下层④为橙红色;
3.根据实验现象“有气泡生成”,则气泡为H2,⑤应该是加入金属镁粉,证明了溶液中含有大量H+,则锥形瓶中液体含大量⑥H+;
通过实验可知,溶液中存在大量的H+和Br-,从而证明苯与液溴在铁作催化剂下发生取代反应,生成溴苯和HBr,其反应方程式为 。
。


科目:高中化学 来源: 题型:
【题目】下列有关化学用语使用正确的是( )
A.CO2分子比例模型:![]()
B.硫离子的离子结构示意图:![]()
C.NH3的电子式:![]()
D.8个中子的碳原子的核素符号:12C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。如图为氢氧燃料电池的结构示意图,回答下列问题:

(1)O2进入的电极为___极。
(2)电池工作时:溶液中的OH-向___(填“正极”或“负极”)迁移,通__(填“H2”或“O2”)一极的电势较低。
(3)写出电池工作时的负极反应式:___。
(4)若电池工作时转移0.01mol电子,理论上消耗标准状态下__mLO2。
(5)若将此燃料电池改成以CH4和O2为原料进行工作时,负极反应式为:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A.16.2g淀粉在催化剂作用下完全水解得到产物的分子数为0.1NA
B.28g乙烯与26g苯中所含的碳碳双键数均为NA
C.1molNa与足量乙醇完全反应,断裂H-O键数目为2NA
D.在密闭容器中,1molO2与2molSO2在适当催化剂作用下充分反应得到生成物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过下列装置(部分夹持仪器已省略)可制取1,2-二溴乙烷。下列说法正确的是( )
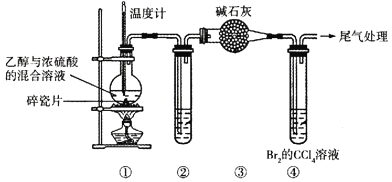
已知:烧瓶中反应后逸出的气体主要是CH2=CH2,含少量SO2、CO2及H2O(g)。
A.配制“乙醇与浓硫酸的混合溶液”时,将乙醇注入浓硫酸中并搅拌
B.②的试管中可盛放酸性KMnO4溶液以除去SO2
C.④中的Br2已完全与乙烯加成的现象是:溶液由橙色变为无色
D.可用分液漏斗从④反应后的混合物中分离出1,2-二溴乙烷并回收CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下面每一小题:
(1)下列各物质中,互为同位素的是__________,互为同素异形体的是______,互为同系物的是_______,互为同分异构体的是________。
①金刚石与石墨 ②12C与l4C ③乙酸和甲酸甲酯 ④ 与
与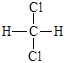
⑤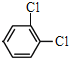 与
与![]() ⑥
⑥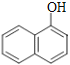 与
与![]()
⑦CH3-CH3和
(2)相对分子质量为72的烷烃,它的一氯代物只有一种,此烷烃的结构简式为______。
(3)写出在光照条件下,甲烷与氯气发生反应生成气态有机物的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按系统命名法填写下列有机物的名称:![]() 名称是_____________________。
名称是_____________________。
(2)写出1,3-丁二烯与足量溴水反应的方程式:_______________________________。
(3)在有机物:①CH3CH3 ②CH2=CH2 ③CH3CH2C![]() CH ④CH3C
CH ④CH3C![]() CCH3 ⑤C2H6 ⑥CH3CH=CH2中,一定互为同系物的是________,一定互为同分异构体的是(填编号)________。
CCH3 ⑤C2H6 ⑥CH3CH=CH2中,一定互为同系物的是________,一定互为同分异构体的是(填编号)________。
(4)某有机物2.3克完全燃烧后,生成4.4克二氧化碳和2.7克水,测得该有机物的蒸气密度是2.054g/L(标准状况)。该有机物的分子式为______;请写出其可能的结构简式并命名____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是

A. 催化剂a表面发生了极性共价键的断裂和形成
B. N2与H2反应生成NH3的原子利用率为100%
C. 在催化剂b表面形成氮氧键时,不涉及电子转移
D. 催化剂a、b能提高反应的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料尼龙66具有良好的抗冲击性、韧性、耐燃油性和阻燃、绝缘等特点,因此广泛应用于汽车、电气等工业中。以下是生产尼龙66的一些途径。
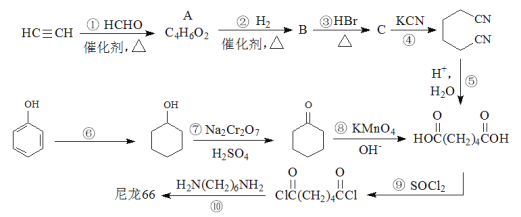
(1)A的结构简式为_____________。
(2)B中官能团的名称是_____________。
(3)反应①~④中,属于加成反应的有_______,反应⑥~⑨中,属于氧化反应的有_______。
(4)请写出反应⑥的化学方程式_____________。
(5)高分子材料尼龙66中含有![]() 结构片段,请写出反应⑩的化学方程式_____________。
结构片段,请写出反应⑩的化学方程式_____________。
(6)某聚合物K的单体与A互为同分异构体,该单体核磁共振氢谱有三个峰,峰面积之比为1:2:3,且能与NaHCO3溶液反应,则聚合物K的结构简式是_____________。
(7)聚乳酸(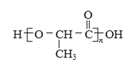 )是一种生物可降解材料,已知羰基化合物可发生下述
)是一种生物可降解材料,已知羰基化合物可发生下述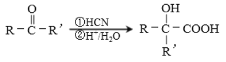 反应: (R′可以是烃基或H原子)。用合成路线图表示用乙醇制备聚乳酸的过程。_______________
反应: (R′可以是烃基或H原子)。用合成路线图表示用乙醇制备聚乳酸的过程。_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com