
【题目】被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。如图为氢氧燃料电池的结构示意图,回答下列问题:

(1)O2进入的电极为___极。
(2)电池工作时:溶液中的OH-向___(填“正极”或“负极”)迁移,通__(填“H2”或“O2”)一极的电势较低。
(3)写出电池工作时的负极反应式:___。
(4)若电池工作时转移0.01mol电子,理论上消耗标准状态下__mLO2。
(5)若将此燃料电池改成以CH4和O2为原料进行工作时,负极反应式为:__。
【答案】正 负 H2 H2-2e-+2OH-═2H2O 56 CH4+10OH-﹣8e-═![]() +7H2O
+7H2O
【解析】
通常在原电池反应中,O2只能得电子,所以通O2的电极为正极,在碱性电解质溶液中,O2得电子的产物与溶液反应生成OH-,电极反应式为O2+4e-+2H2O==4OH-;通H2的电极为负极,H2失电子的产物与电解质溶液反应生成H2O,电极反应式为H2-2e-+2OH-==2H2O。
(1)由以上分析知,O2进入的电极为正极。答案为:正;
(2)电池工作时:阴离子向负极移动,则溶液中的OH-向负极迁移;在原电池中,负极的电势较低,则通H2一极的电势较低。答案为:负;H2;
(3)电池工作时,通H2的电极为负极,H2失电子的产物与电解质溶液反应生成H2O,电极反应式为H2-2e-+2OH-==2H2O。答案为:H2-2e-+2OH-═2H2O;
(4)在正极O2——4e-,若电池工作时转移0.01mol电子,理论上消耗标准状态下O2的体积为![]() =56mL。答案为:56;
=56mL。答案为:56;
(5)若将此燃料电池改成以CH4和O2为原料进行工作时,负极为通CH4的电极,CH4失电子的产物与OH-反应生成![]() 和水,电极反应式为:CH4+10OH-﹣8e-═
和水,电极反应式为:CH4+10OH-﹣8e-═![]() +7H2O。答案为:CH4+10OH-﹣8e-═
+7H2O。答案为:CH4+10OH-﹣8e-═![]() +7H2O。
+7H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】自来水加工处理流程如图,下列有关说法不正确的是( )

A.若用FeSO4作混凝剂,最终铁将以Fe(OH)2形式进入反应沉淀池
B.投药时常加入适量的石灰,是为了除去水中Mg2+、HCO3﹣等
C.自来水生产中,前面加氯起消毒杀菌作用,后面加氯是保持水中有效氯的含量,防止自来水二次污染
D.用ClO2消毒自来水,消毒效率是等质量氯气的2.63倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七水硫酸锌别名皓矾,常用作媒染剂、收敛剂、木材防腐剂。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4·7H2O的流程如下:
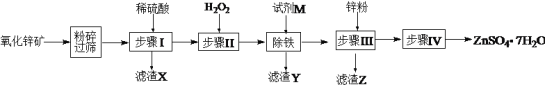
在该流程中,相关离子生成氢氧化物的pH如表:
开始沉淀时pH | 完全沉淀时pH | |
Zn2+ | 5.4 | 6.4 |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Cu2+ | 5.6 | 6.4 |
请回答下列问题:
(1)粉碎氧化锌矿石的目的是______________;滤渣X的成分是________________。
(2)步骤Ⅱ中加入H2O2目的是:_______________,发生反应的离子方程式为:______________。
(3)“除铁”步骤中加入试剂M调节溶液的pH,试剂M可以是________(填化学式,一种即可),控制溶液的pH范围为:_________。同时还需要将溶液加热,其目的是:__________。
(4)滤渣Z的成分是____________。
(5)取28.70 g ZnSO4·7H2O(相对分子质量:287)加热至不同温度,剩余固体的质量变化如图所示:
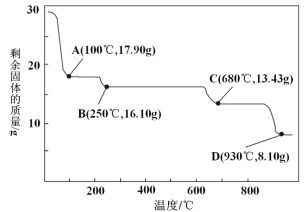
①步骤Ⅳ中的烘干操作需在减压条件下进行,其原因是____________。
②680 ℃时所得固体的化学式为________________。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.C4H10的一氯代物有2种
B.正戊烷分子中所有的碳原子均在同一条直线上
C.可用溴水来除去甲烷中混有的少量乙烯
D.某烃的分子式为C3H6,符合通式CnH2n,故该分子一定属于烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃复分解反应可示意如下:

利用上述方法制备核苷类抗病毒药物的重要原料W的合成路线如下:

回答下列问题:
(1)B的化学名称为____。
(2)由B到C的反应类型为____。
(3)D到E的反应方程式为____。
(4)化合物F在Grubbs II催化剂的作用下生成G和另一种烯烃,该烯烃的结构简式是____。
(5)H中官能团的名称是 ______.
(6)化合物X是H的同分异构体,可与FeCl3溶液发生显色反应,1mol X最多可与3mol NaOH反应,其核磁共振氢谱为四组峰,峰面积比为3:2:2:1。写出两种符合要求的X的结构简式:_____。
(7)由![]() 为起始原料制备
为起始原料制备 的合成路线如下,请补充完整(无机试剂任选)。
的合成路线如下,请补充完整(无机试剂任选)。
 _________________。
_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种二元弱酸。常温下,向H2C2O4溶液中逐滴加入NaOH溶液,混合溶液中lgX[X为![]() 或
或 ]与pH的变化关系如图所示。下列说法一定正确的是
]与pH的变化关系如图所示。下列说法一定正确的是
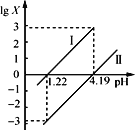
A.Ⅰ表示lg![]() 与pH的变化关系
与pH的变化关系
B.pH=1.22的溶液中:2c(C2O42-)+c(HC2O4-)=c(Na+)
C.根据图中数据计算可知,Ka2(H2C2O4)的数量级为10-4
D.pH 由1.22到4.19的过程中,水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各实验装置的叙述中,不正确的是( )
A.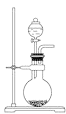 可用于实验室制取少量NH3或O2
可用于实验室制取少量NH3或O2
B. 可用从a处加水的方法检验装置②的气密性
可用从a处加水的方法检验装置②的气密性
C.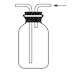 实验室可用装置③收集H2、NH3
实验室可用装置③收集H2、NH3
D.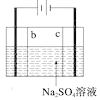 制硫酸和氢氧化钠,其中b为阳离子交换膜、c为阴离子交换膜
制硫酸和氢氧化钠,其中b为阳离子交换膜、c为阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用图1装置(夹持仪器已省略)制备溴苯,并探究该反应原理。
Ⅰ.制备溴苯
(1)装置中长导管a的作用是__________、导出气体。
(2)本实验所获得的溴苯为褐色,是因为_________.
Ⅱ.分离提纯
已知,溴苯与苯互溶,液溴、苯、溴苯的沸点依次为59℃、80℃、156℃。同学们设计了如图2流程:
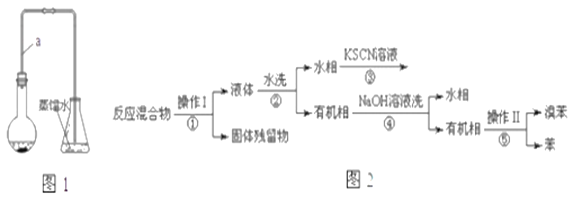
(3)操作Ⅱ为________.
(4)流程②和④中,需要用到的玻璃仪器是烧杯、___;流程③的现象为____,流程④的作用是_____.
Ⅲ.探究原理
(5)反应结束后,某同学取少量锥形瓶中的液体于试管中,再滴入几滴AgNO3溶液,出现浅黄色浑浊,从而判断反应一定生成了HBr,你认为该同学的判断________(填“合理”、“不合理”)。
(6)为探究锥形瓶中溶液的离子,请完成如表探究实验方案(限选试剂:镁粉、四氯化碳、氯水、溴水、蒸馏水)
实验步骤 | 预期现象 | 结论 |
1.将锥形瓶中的液体转入分液漏斗,加足量①__,振荡后分液。分别取少量②_层溶液于试管A、B中 | _______ | ______ |
2.向试管A中加入少量③___和四氯化碳,振荡后静置; | 溶液分层,下层显④___色 | 锥形瓶中液体含大量Br |
3.向试管B中加入⑤___. | 有汽泡生成 | 锥形瓶中液体含大量⑥___ |
根据上述结论推断,制备溴苯的反应属于___反应,其反应方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药麻黄成分中含有生物碱、黄酮、鞣质、挥发油、有机酚、多糖等许多成分,其中一种有机酚的结构简式如图。下列说法正确的是 ( )
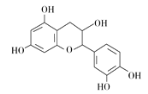
A. 分子中所有碳原子可以处于同一平面
B. 分子式为C15H12O7
C. 1 mol该有机物跟足量浓溴水反应,最多消耗5 mol Br2
D. 1 mol该有机物与NaOH溶液反应最多消耗5 mol NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com