
����Ŀ����ˮ����п����𩷯��������ýȾ������������ľ�ķ���������ҵ��������п��(��Ҫ�ɷ�ΪZnO������ZnSiO3��FeCO3��CuO��)����ZnSO4��7H2O���������£�
�ڸ������У���������������������pH�����
��ʼ����ʱpH | ��ȫ����ʱpH | |
Zn2+ | 5.4 | 6.4 |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Cu2+ | 5.6 | 6.4 |
��ش��������⣺
(1)��������п��ʯ��Ŀ����______________������X�ijɷ���________________��
(2)������м���H2O2Ŀ���ǣ�_______________��������Ӧ�����ӷ���ʽΪ��______________��
(3)�������������м����Լ�M������Һ��pH���Լ�M������________(�ѧʽ��һ�ּ���)��������Һ��pH��ΧΪ��_________��ͬʱ����Ҫ����Һ���ȣ���Ŀ���ǣ�__________��
(4)����Z�ijɷ���____________��
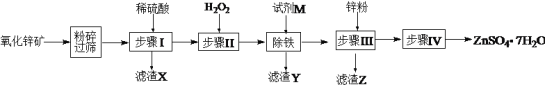
(5)ȡ28.70 g ZnSO4��7H2O(��Է���������287)��������ͬ�¶ȣ�ʣ�����������仯��ͼ��ʾ��
�ٲ�����еĺ�ɲ������ڼ�ѹ�����½��У���ԭ����____________��
��680 ��ʱ���ù���Ļ�ѧʽΪ________________��
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4��H2O
���𰸡�����ȱ�������ӿ췴Ӧ���ʡ���߽�ȡ�� H2SiO3 ��Fe2+������Fe3+�����ں��������н���Ԫ�س�ȥ 2Fe2++H2O2+2H+=2Fe3++2H2O ZnO��ZnCO3��Zn(OH)2 3.2��pH��5.4 ��ֹ���������������壬���ڷ��� Cu��Zn ���ͺ���¶ȣ���ֹZnSO4��7H2Oʧȥ�ᾧˮ b
��������
(1)����п��ʯ���������ȱ�������ӿ췴Ӧ���ʡ���߽�ȡ�ʣ��ڼ�H2SO4���ܹ����У�ZnSiO3��H2SO4������H2SiO3��
(2)�ڲ������м���H2O2��������Һ�е�Fe2+����������ԭ��Ӧ��
(3)Ҫ�кͶ���H2SO4���Ҳ����������ʣ����Լ���ZnO��ZnCO3��Zn(OH)2�Ȼ�������ݱ�����֪��Fe3+ȫ��������pH��3.2��Zn2+��ʼ������pHΪ5.4�����ȿ��Է�ֹ���������������壬���ڷ��룻
(4)Ϊ�˽�Cu2+ȫ���û������������п�۹���������Z�а���Cu��Zn��
(5)������ZnSO4��7H2O��ʧȥ�ᾧˮ�����ʱҪ�ʵ������¶ȣ�
�ڸ���ͼ�������
(1)����п��ʯ���������ȱ�������ӿ췴Ӧ���ʡ���߽�ȡ�ʣ��ڼ�H2SO4���ܹ����У�ZnSiO3��H2SO4������H2SiO3��������X�ijɷ�ΪH2SiO3���ʴ�Ϊ������ȱ�������ӿ췴Ӧ���ʡ���߽�ȡ�ʣ� H2SiO3��
(2)�ڲ������м���H2O2��������Һ�е�Fe2+����������ԭ��Ӧ����Ӧ�����ӷ���ʽΪ��2Fe2��+H2O2+2H��![]() 2Fe3��+2H2O���ʴ�Ϊ����Fe2+������Fe3+�����ں��������н���Ԫ�س�ȥ��2Fe2��+H2O2+2H��
2Fe3��+2H2O���ʴ�Ϊ����Fe2+������Fe3+�����ں��������н���Ԫ�س�ȥ��2Fe2��+H2O2+2H��![]() 2Fe3��+2H2O��
2Fe3��+2H2O��
(3)Ҫ�кͶ���H2SO4���Ҳ����������ʣ����Լ���ZnO��ZnCO3��Zn(OH)2�Ȼ�������ݱ�����֪��Fe3+ȫ��������pH��3.2��Zn2+��ʼ������pHΪ5.4����pH�ķ�ΧΪ��3.2��pH��5.4�����ȿ��Է�ֹ���������������壬���ڷ��룬�ʴ�Ϊ��ZnO��ZnCO3��Zn(OH)2�� 3.2��pH��5.4�����ȿ��Է�ֹ���������������壬���ڷ��룻
(4)Ϊ�˽�Cu2+ȫ���û������������п�۹���������Z�а���Cu��Zn���ʴ�Ϊ��Cu��Zn��
(5)������ZnSO4��7H2O��ʧȥ�ᾧˮ�����ʱҪ�ʵ������¶ȣ�
��n(ZnSO4��7H2O)=![]() =0.1 mol�����ȹ���������ZnSO4��H2O������Ϊ17.90 g(100 ��)������ZnSO4������Ϊ16.10 g(250 ��)������ZnO������Ϊ8.10 g(930 ��)���ݴ�ͨ���ų���ȷ��680 ��ʱ���ù���Ļ�ѧʽΪZn3O(SO4)2���ʴ�Ϊ�����ͺ���¶ȣ���ֹZnSO4��7H2Oʧȥ�ᾧˮ��b��
=0.1 mol�����ȹ���������ZnSO4��H2O������Ϊ17.90 g(100 ��)������ZnSO4������Ϊ16.10 g(250 ��)������ZnO������Ϊ8.10 g(930 ��)���ݴ�ͨ���ų���ȷ��680 ��ʱ���ù���Ļ�ѧʽΪZn3O(SO4)2���ʴ�Ϊ�����ͺ���¶ȣ���ֹZnSO4��7H2Oʧȥ�ᾧˮ��b��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ![]() ��һ���ܱ������н��У����д�ʩ����ʹ��Ӧ����������ǣ� ��
��һ���ܱ������н��У����д�ʩ����ʹ��Ӧ����������ǣ� ��
����������![]() �������¶Ȣ�������䣬��ͨ��
�������¶Ȣ�������䣬��ͨ��![]() ����С�������ѹǿ��������䣬��ͨ��He��ѹǿ���䣬��ͨ��He
����С�������ѹǿ��������䣬��ͨ��He��ѹǿ���䣬��ͨ��He
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ����ʹ����ȷ���ǣ� ��
A.CO2���ӱ���ģ�ͣ�![]()
B.�����ӵ����ӽṹʾ��ͼ��![]()
C.NH3�ĵ���ʽ��![]()
D.8�����ӵ�̼ԭ�ӵĺ��ط��ţ�12C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���ͼװ�õ�˵����ȷ���ǣ� ��

A. ��K��c���ӣ�ʯī�缫�ĵ缫��ӦΪ��O2+4e-+4H+=2H2O
B. ��K��c���ӣ�����Һ�е�Na�������缫�ƶ�
C. ��K��d���ӣ����缫�ĵ缫��ӦΪ��2H2O +2e-=H2��+2OH-
D. ��K��d���ӣ���ʱ�������ϡ�����ʹ�������Һ��ԭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.ij�о���ѧϰС����ݷ�Ӧ: 2KMnO4��10FeSO4��8H2SO4=2MnSO4��5Fe2(SO4)3��K2SO4��8H2O���������ԭ��أ����мס������ձ��и����ʵ����ʵ���Ũ�Ⱦ�Ϊ1 mol��L��1����Һ�������Ϊ200 mL��������װ�б���K2SO4��Һ��

�ش��������⣺
(1)��ԭ��ص�������ʯī________(����a������b��)������________��Ӧ��
(2)��ع���ʱ�������е�SO42������________(����������������)�ձ���
(3)���ձ��еĵ缫��Ӧʽ�ֱ�Ϊ
��_____________________��
��____________________��
(4)����������Һ������仯��MnSO4Ũ�ȱ�Ϊ1.5 mol��L��1����Ӧ��ת�Ƶĵ���Ϊ________mol��
��.��������(II)[Co(H2PO2)2]�㷺���ڻ�ѧ���ܣ��Խ����ܺʹ�������Ϊԭ�ϣ��������ҵ������۵�ⷨ�Ʊ���ԭ����ͼ��
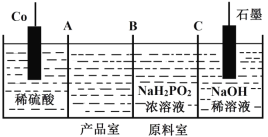
(5)A��B��C��Ϊ���ӽ���Ĥ������Ϊ�����ӽ���Ĥ����____________��
(6)�����ĵ缫��ӦʽΪ________________��
(7)���һ��ʱ�����������Һ��pH______(��������������С������������)��
(8)��Co(H2PO2)2��Һ��ѧ��������ǿ����������ͨ����������������ԭ��Ӧ����Ӧ��ͬʱ������HPO32���������ӷ���ʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�����ڱ���Ԫ�������ɣ��ж�����������ȷ���ǣ� ��
A.��̬�⻯����ȶ��ԣ�CH4SiH4
B.��Ԫ������һ��Ԫ���γɵĻ�����һ���ǹ��ۻ�����
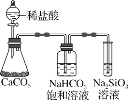
C.��ͼ��ʾʵ��֤��Ԫ�صķǽ����ԣ�C��Si
D.��������![]() �������ĵ�118��Ԫ�������ڱ���λ�ڵ�������VIII��
�������ĵ�118��Ԫ�������ڱ���λ�ڵ�������VIII��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ϊ�ı�δ�������ʮ���¿Ƽ�֮һ��ȼ�ϵ�ؾ�������Ⱦ������������Ч�ʵ��ص㡣��ͼΪ����ȼ�ϵ�صĽṹʾ��ͼ���ش��������⣺

(1)O2����ĵ缫Ϊ___����
(2)��ع���ʱ����Һ�е�OH-��___������������������������Ǩ�ƣ�ͨ__������H2������O2����һ���ĵ��ƽϵ͡�
(3)д����ع���ʱ�ĸ�����Ӧʽ��___��
(4)����ع���ʱת��0.01mol���ӣ����������ı�״̬��__mLO2��
(5)������ȼ�ϵ�ظij���CH4��O2Ϊԭ�Ͻ��й���ʱ��������ӦʽΪ��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��ϵͳ��������д�����л�������ƣ�![]() ������_____________________��
������_____________________��
(2)д��1,3-����ϩ��������ˮ��Ӧ�ķ���ʽ��_______________________________��
(3)������CH3CH3 ��CH2=CH2 ��CH3CH2C![]() CH ��CH3C
CH ��CH3C![]() CCH3 ��C2H6 ��CH3CH=CH2�У�һ����Ϊͬϵ�����________��һ����Ϊͬ���칹�����(����)________��
CCH3 ��C2H6 ��CH3CH=CH2�У�һ����Ϊͬϵ�����________��һ����Ϊͬ���칹�����(����)________��
(4)ij�л���2.3����ȫȼ�պ�����4.4�˶�����̼��2.7��ˮ����ø��л���������ܶ���2.054g/L(��״��)�����л���ķ���ʽΪ______����д������ܵĽṹ��ʽ������____________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com