
【题目】有关如图装置的说法正确的是( )

A. 若K与c连接,石墨电极的电极反应为:O2+4e-+4H+=2H2O
B. 若K与c连接,则溶液中的Na+向铁电极移动
C. 若K与d连接,铁电极的电极反应为:2H2O +2e-=H2↑+2OH-
D. 若K与d连接,短时间后,加适量稀盐酸可使电解质溶液复原
【答案】C
【解析】
A、若K与c连接,是原电池,石墨电极是正极,电极反应为:O2+4e-+2H2O=4OH-;
B、若K与c连接,是原电池,溶液中的Na+向正极移动;
C、若K与d连接是电解池,铁电极是阴极,发生还原反应,电极反应为:2H2O +2e-=H2↑+2OH-;
D、若K与d连接,短时间内是电解饱和食盐水,产生NaOH、氢气和氯气,短时间后通入氯化氢气体可使电解质溶液复原。
A、若K与c连接,是原电池,石墨电极是正极,是吸氧腐蚀,正极的电极反应为:O2+4e-+2H2O=4OH-,故A错误;
B、若K与c连接,是原电池,溶液中的Na+向正极移动,即钠离子向石墨极移动,故B错误;
C、若K与d连接是电解池,铁电极是阴极,发生还原反应,电极反应为:2H2O +2e-=H2↑+2OH-,故C正确;
D、若K与d连接,短时间内是电解饱和食盐水,产生NaOH、氢气和氯气,短时间后通入氯化氢气体可使电解质溶液复原,但深度电解后,要电解部分水,要加入稀盐酸,才可使电解质溶液复原,故D错误;
故选C。


 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,20mL0.40mol/LH2O2溶液发生催化分解.不同时刻测得生成O2的体积(已折算为标准状况)如表.
t/min | 0 | 2 | 4 | 6 | 8 | 10 | ||||
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)≈1.67×10-2mol/(Lmin)
B.6~10min的平均反应速率:v(H2O2)<1.67×10-2mol/(Lmin)
C.反应至6min时,c(H2O2)=0.30mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)![]() N2O4g)(无色),如图所示.
N2O4g)(无色),如图所示.

(1)曲线 (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线.
(2)若降低温度,则v(正) ,v(逆) .(填“加快”或“减慢”或“不变”).
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=0.3mol/(Ls),乙中v(N2O4)=6mol/(Lmin),则 中反应更快.
(4)在0到3min中内N2O4的反应速率为 .
(5)下列叙述能说明该反应已达到化学平衡状态的是(填标号) ;
A.v(NO2)=2v(N2O4) |
B.容器内压强不再发生变化 |
C.X的体积分数不再发生变化 |
D.容器内气体原子总数不再发生变化 |
E.相同时间内消耗n mol的Y的同时生成2n mol的X
F.相同时间内消耗n mol的Y的同时消耗2n mol的X.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 W、X、Y、Z 的原子序数依次递增,a、b、c、d、e、f 是由这些元素组成的化合物,d 是淡黄色粉末,m 为元素 Y 的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法错误的是

A.简单离子半径:Z<Y
B.简单气态氢化物的热稳定性:Y<X
C.阴离子的还原性:Y>W
D.W2Y2 中含有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,直线交点处的圆圈为NaCl晶体中Na+或Cl-所处的位置,这两种离子在空间三个互相垂直的方向上都是等距离排列的。

(1)请将其中代表Na+的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图。________
(2)晶体中,在每个Na+的周围与它最接近的且距离相等的Na+共有________个。
(3)晶体中每一个重复的结构单元叫晶胞。在NaCl晶胞中正六面体的顶点上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-的个数等于__,即(填计算式)____;Na+的个数等于____,即(填计算式)____。
(4)设NaCl的摩尔质量为Mr g·mol-1,食盐晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA。食盐晶体中两个距离最近的钠离子中心间的距离为______cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七水硫酸锌别名皓矾,常用作媒染剂、收敛剂、木材防腐剂。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4·7H2O的流程如下:
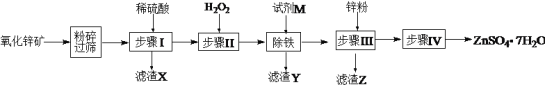
在该流程中,相关离子生成氢氧化物的pH如表:
开始沉淀时pH | 完全沉淀时pH | |
Zn2+ | 5.4 | 6.4 |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Cu2+ | 5.6 | 6.4 |
请回答下列问题:
(1)粉碎氧化锌矿石的目的是______________;滤渣X的成分是________________。
(2)步骤Ⅱ中加入H2O2目的是:_______________,发生反应的离子方程式为:______________。
(3)“除铁”步骤中加入试剂M调节溶液的pH,试剂M可以是________(填化学式,一种即可),控制溶液的pH范围为:_________。同时还需要将溶液加热,其目的是:__________。
(4)滤渣Z的成分是____________。
(5)取28.70 g ZnSO4·7H2O(相对分子质量:287)加热至不同温度,剩余固体的质量变化如图所示:
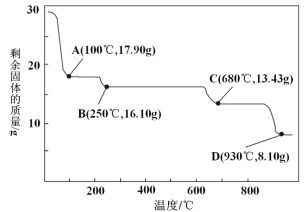
①步骤Ⅳ中的烘干操作需在减压条件下进行,其原因是____________。
②680 ℃时所得固体的化学式为________________。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是( )
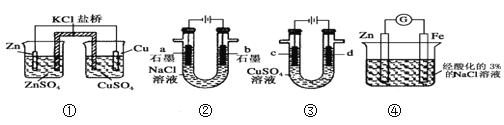
A. 装置②中滴入酚酞,a极附近变红B. 装置①中,一段时间后SO42﹣浓度增大
C. 用装置③精炼铜时,c极为粗铜D. 装置④中发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃复分解反应可示意如下:

利用上述方法制备核苷类抗病毒药物的重要原料W的合成路线如下:

回答下列问题:
(1)B的化学名称为____。
(2)由B到C的反应类型为____。
(3)D到E的反应方程式为____。
(4)化合物F在Grubbs II催化剂的作用下生成G和另一种烯烃,该烯烃的结构简式是____。
(5)H中官能团的名称是 ______.
(6)化合物X是H的同分异构体,可与FeCl3溶液发生显色反应,1mol X最多可与3mol NaOH反应,其核磁共振氢谱为四组峰,峰面积比为3:2:2:1。写出两种符合要求的X的结构简式:_____。
(7)由![]() 为起始原料制备
为起始原料制备 的合成路线如下,请补充完整(无机试剂任选)。
的合成路线如下,请补充完整(无机试剂任选)。
 _________________。
_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业中很多重要的原料都是来源于石油化工,回答下列问题

(1)A的结构简式为__________________
(2)丙烯酸中含氧官能团的名称为__________________
(3)写出反应①的反应类型:_____________
(4)写出上述框图中某些过程的化学方程式:
过程②_________________________
过程④______________________
过程⑤_________________
(5)下列有关实验的说法中正确的是_______
A. 除去乙酸乙酯中的乙酸,可加入NaOH溶液,振荡后静置分液
B. 有机物C与丙烯酸属于同系物
C. 聚丙烯酸能够使酸性高锰酸钾溶液褪色
D. 除去硝基苯中混有的少量浓HNO3和H2SO4,可将其倒入到一定量的NaOH溶液中,振荡后静置分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com