
【题目】烯烃复分解反应可示意如下:

利用上述方法制备核苷类抗病毒药物的重要原料W的合成路线如下:

回答下列问题:
(1)B的化学名称为____。
(2)由B到C的反应类型为____。
(3)D到E的反应方程式为____。
(4)化合物F在Grubbs II催化剂的作用下生成G和另一种烯烃,该烯烃的结构简式是____。
(5)H中官能团的名称是 ______.
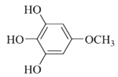
(6)化合物X是H的同分异构体,可与FeCl3溶液发生显色反应,1mol X最多可与3mol NaOH反应,其核磁共振氢谱为四组峰,峰面积比为3:2:2:1。写出两种符合要求的X的结构简式:_____。
(7)由![]() 为起始原料制备
为起始原料制备 的合成路线如下,请补充完整(无机试剂任选)。
的合成路线如下,请补充完整(无机试剂任选)。
 _________________。
_________________。
【答案】丙烯醛 加成反应 ![]() CH2=CH2 羧基、碳碳双键
CH2=CH2 羧基、碳碳双键 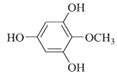 、
、

【解析】
(1)B为![]() ,其化学名称为丙烯醛;
,其化学名称为丙烯醛;
(2)由B到C是丙烯醛与水在磷酸及加热条件下发生加成反应生成HOCH2CH2CHO,反应类型为加成反应;
(3)根据 ![]() 可知D到E为酯化反应,反应方程式为
可知D到E为酯化反应,反应方程式为![]() ;
;
(4)化合物F(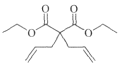 )在Grubbs II催化剂的作用下生成G(
)在Grubbs II催化剂的作用下生成G(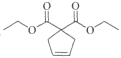 )和另一种烯烃,根据反应原理及碳原子数目可知,该烯烃为乙烯,结构简式是CH2=CH2;
)和另一种烯烃,根据反应原理及碳原子数目可知,该烯烃为乙烯,结构简式是CH2=CH2;
(5)根据G在氢氧化钾溶液中加热水解生成羧酸钾和乙醇,再酸化得到羧酸H为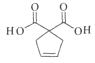 ,H中官能团的名称是羧基、碳碳双键;
,H中官能团的名称是羧基、碳碳双键;
(6)化合物X是H的同分异构体,可与FeCl3溶液发生显色反应,说明含有酚羟基,1mol X最多可与3mol NaOH反应,则含有三个酚羟基,其核磁共振氢谱为四组峰,峰面积比为3:2:2:1。符合要求的X的结构简式有 、
、 ;
;
(7)由![]() 为起始原料制备
为起始原料制备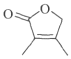 ,
,![]() 与氯化氢在催化剂及加热条件下反应生成
与氯化氢在催化剂及加热条件下反应生成![]() ,
,![]() 在酸性高锰酸钾溶液中反应生成
在酸性高锰酸钾溶液中反应生成![]() ,
,![]() 在氢氧化钠的醇溶液中加热发生消去反应生成
在氢氧化钠的醇溶液中加热发生消去反应生成![]() ,
,![]() 在稀硫酸作用下生成
在稀硫酸作用下生成![]() ,
,![]() 与
与![]() 发生酯化反应生成
发生酯化反应生成![]() ,
,![]() 在Grubbs II催化剂的作用下生成
在Grubbs II催化剂的作用下生成 ,合成路线如下:
,合成路线如下: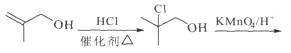
 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. CH4,C2H2,HCN都是含有极性键的非极性分子
B. CO2与SO2的立体构型相似,都是非极性分子
C. ![]() 分子中含有1个手性碳原子
分子中含有1个手性碳原子
D. 无机含氧酸分子中有几个氢原子,它就属于几元酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磺酰氯(SO2Cl2)主要用作氯化剂或氯磺化剂,也用于制造医药品、染料、表面活性剂等,熔、沸点分别为-54.1℃和69.2℃。

(1)SO2Cl2中S的化合价为______,SO2Cl2在潮湿空气中发生剧烈反应,散发出具有刺激性和腐蚀性的“发烟”,该反应的化学方程式为____________________。
(2)拟用干燥的SO2和Cl2通入如图装置(省略夹持装置)制取磺酰氯。
①仪器A的名称为___________,通水方向为___________(填 “a→b”或“b→a”),装置B的作用是___________。
②反应装置中的活性炭的作用可能为:______________。
③若SO2和Cl2未经干燥,就通入装置中,也散发出具有刺激性和腐蚀性的“发烟”,该反应的化学方程式为_________。
④滴定法测定磺酰氯的纯度:取1.800g产品,加入到100mL0.5000mol·L1NaOH溶液中加热充分水解,冷却后加蒸馏水准确稀释至250mL,取25mL溶液于锥形瓶中,滴加2滴甲基橙,用0.1000mol·L1标准HCl溶液滴定至终点,重复实验三次取平均值,消耗10.00mL。 达到滴定终点的现象为___________,产品的纯度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,部分物质的电离常数如表所示:
化学式 | CH3COOH | H2CO3 |
电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
请回答下列问题:
(1)相同pH的CH3COONa、NaHCO3、Na2CO3浓度由大到小的顺序为__________
(2)常温下0.1mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母,下同)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(H+)/c(OH-)
(3)现有10mLpH=2的盐酸溶液,进行以下操作:
a.与pH=5的盐酸等体积混合,则pH=_____________;
b.向该盐酸溶液中加入10mL0.02mol/LCH3COONa溶液,则该混合溶液中存在的物料守恒式为__________________;
c.向该盐酸溶液中加入等体积等浓度的Na2CO3溶液,则混合溶液中存在的电荷守恒式为_______________________;
d. 下列关于体积都为10mL,pH=2的A(盐酸)和B(CH3COOH)溶液说法正确的是_____ (填写序号)。
①与等量的锌反应开始反应时的速率A=B
②与等量的锌反应(锌完全溶解,没有剩余)所需要的时间A>B
③加水稀释100倍,pH大小比较:4=A>B>2
④物质的量浓度大小比较:A>B
⑤分别与10mLpH=12的NaOH溶液充分反应后的溶液pH大小比较:A<B
e. 现用标准HCl溶液滴定氨水,应选用________指示剂,下列操作会导致测定结果偏高的是___。
A.未用HCl标准溶液润洗滴定管
B.滴定前锥形瓶内有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】巴豆酸的结构简式为CH3-CH=CH-COOH。现有①氯化氢;②溴水;③纯碱溶液;④丁醇;⑤酸性高锰酸钾溶液。试根据巴豆酸的结构特点,判断在一定条件下,能与巴豆酸反应的物质是
A.②④⑤B.①③④C.①②③④D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是
A. 原子半径:Na>Mg>O
B. 13C和14C属于同位素
C. 0族元素是同周期中非金属性最强的元素
D. N和P属于第ⅤA族元素,HNO3酸性比H3PO4的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体,相应的实验流程如图所示。

请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X____。
(2)上述实验流程中①②③步均要进行的实验操作是____(填操作名称)。
(3)上述实验流程中加入过量Na2CO3溶液的目的是____________。
(4)按此实验方案得到的溶液3中肯定含有杂质。为了解决这个问题,可以向溶液3中加入适量的________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.I A族元素均是碱金属元素.
B.第VIA族元素随原子序数的增大,其对应的最简单氢化物的还原性逐渐增强
C.氯的氧化物对应水化物的酸性一定强于碳酸的酸性
D.同周期从左到右主族元素对应单质的熔、沸点依次降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com