
【题目】下列说法中正确的是( )
A. CH4,C2H2,HCN都是含有极性键的非极性分子
B. CO2与SO2的立体构型相似,都是非极性分子
C. ![]() 分子中含有1个手性碳原子
分子中含有1个手性碳原子
D. 无机含氧酸分子中有几个氢原子,它就属于几元酸
【答案】C
【解析】
A.HCN的结构不对称,为极性分子;
B.二氧化碳为直线型、非极性分子,而二氧化硫为V型、极性分子;
C.碳原子上连接四个不同的原子或原子团的为手性碳原子;
D.据酸电离出的氢离子数目可以将酸分为一元酸、二元酸、多元酸,含氧酸中H原子个数与酸的元数不一定相等。
A.CH4是含极性键的非极性分子,C2H2是既含极性键又含非极性键的非极性分子,而HCN为含极性键的极性分子,故A错误;
B.SO2分子为V形结构,分子中正负电荷中心不重合,属于极性分子,CO2分子为直线型对称结构,分子中正负电荷中心重合,属于非极性分子,故B错误;
C.![]() 分子中左边第3个C原子连接了四个不同的原子或原子团,为手性碳原子,故C正确;
分子中左边第3个C原子连接了四个不同的原子或原子团,为手性碳原子,故C正确;
D.无机含氧酸中H原子个数与酸的元数不一定相等,如H3PO3为二元酸,故D错误。
故选C。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】常见的食品脱氧剂多为无机铁系脱氧剂,其主要成分为活性铁粉。脱氧中的一步主要反应为:4Fe(OH)2+O2+2H2O=4Fe(OH)3(红褐色固体)。

(1)Fe(OH)3中铁元素化合价为______,该脱氧反应中还原剂是_________。
(2)某化学兴趣小组用食品脱氧剂(2g铁粉、0.5g活性炭、0.5g氯化钠)进行如下两个实验。
实验Ⅰ: 请回答:
①操作Ⅰ的名称是________,溶液丙中一定含有的金属阳离子是__________(写离子符号);
实验Ⅱ:将乙烘干后进行如下实验,物质之间的转化关系如下图(部分产物略去)。

②写出反应②的离子方程式,并用双线桥法表示电子转移的方向和数目_________;
③向溶液C中加入BaCl2溶液,有白色沉淀产生,其离子方程式为____________;反应③的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小王同学准备用CuSO4·5H2O配制490 mL 0.1 mol/L的溶液。
(1)小王同学选用的玻璃仪器有:烧杯,玻璃棒,胶头滴管,___。
(2)玻璃棒在该实验中有重要的用途,分别是___和____;
(3)小王同学通过计算,用托盘天平称取___g CuSO4·5H2O。
(4)物质的量浓度误差(填偏高、偏低、无影响)
A.若容量瓶洗净后未干燥,其中残留少量水,则所配制的溶液浓度将_____;
B.定容时,若眼睛俯视,则所配制的溶液浓度将_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标出下列氧化还原反应中电子转移的方向和数目____________
![]()
该反应的还原产物是______________;____________元素被氧化;若反应有![]() 电子发生转移,则被还原的氧化剂是_________mol。
电子发生转移,则被还原的氧化剂是_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
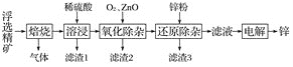
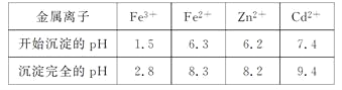
相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为__________。
(2)滤渣1的主要成分除SiO2外还有________;氧化除杂工序中ZnO的作用是_____________,若不通入氧气,其后果是___________。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为__________。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为__________;沉积锌后的电解液可返回________工序继续使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③C.①②③②④D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用乙苯![]() 经催化脱氢生产苯乙烯
经催化脱氢生产苯乙烯![]() ,下列说法错误的是
,下列说法错误的是
A. 乙苯可通过石油催化重整获得
B. 乙苯的同分异构体超过四种
C. 苯乙烯与氯化氢反应可生成氯代苯乙烯
D. 乙苯和苯乙烯分子所有碳原子均可处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
(1)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体转化为二氧化碳和水,达到无害化.有关甲醛、苯、二氧化碳及水说法正确的是_____。
①苯与B3N3H6的总电子数相等;
②甲醛、苯分子中碳原子均采用sp3杂化;
③苯、二氧化碳、水和甲醛都是非极性分子;
④水的沸点比甲醛高得多,是因为水分子间能存在氢键,甲醛分子间不存在氢键。
(2)2007年诺贝尔物理学奖为法国科学家阿尔贝费尔和德国科学家彼得格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就.某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca,Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。
①用A,B,O表示这类特殊晶体的化学式:_______ 。
②Cr、Mn的核外特征电子排布式分别为:Cr:[Ar]3d54s1、Mn:[Ar]3d54s2,则它们第一电离能由小到大的排列顺序是:_______用“<”排列)。
(3)CO2的空间构型为______;固体CO2与SiO2熔沸点差异很大的原因是________
(4)冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图2)类似,其中空心球所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似.每个冰晶胞平均占有__个水分子;冰晶胞与金刚石晶胞微粒排列方式相同的原因是_______ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃复分解反应可示意如下:

利用上述方法制备核苷类抗病毒药物的重要原料W的合成路线如下:

回答下列问题:
(1)B的化学名称为____。
(2)由B到C的反应类型为____。
(3)D到E的反应方程式为____。
(4)化合物F在Grubbs II催化剂的作用下生成G和另一种烯烃,该烯烃的结构简式是____。
(5)H中官能团的名称是 ______.
(6)化合物X是H的同分异构体,可与FeCl3溶液发生显色反应,1mol X最多可与3mol NaOH反应,其核磁共振氢谱为四组峰,峰面积比为3:2:2:1。写出两种符合要求的X的结构简式:_____。
(7)由![]() 为起始原料制备
为起始原料制备 的合成路线如下,请补充完整(无机试剂任选)。
的合成路线如下,请补充完整(无机试剂任选)。
 _________________。
_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com