
����Ŀ��������ʳƷ��������Ϊ����ϵ������,����Ҫ�ɷ�Ϊ�������ۡ������е�һ����Ҫ��ӦΪ:4Fe(OH)2+O2+2H2O=4Fe(OH)3(���ɫ����)��

(1)Fe(OH)3����Ԫ�ػ��ϼ�Ϊ______,��������Ӧ�л�ԭ����_________��
(2)ij��ѧ��ȤС����ʳƷ������(2g���ۡ�0.5g����̿��0.5g�Ȼ���)������������ʵ�顣
ʵ��� ��ش�
�ٲ������������________����Һ����һ�����еĽ�����������__________(д���ӷ���);
ʵ����Һ�ɺ��������ʵ�飬����֮���ת����ϵ����ͼ�����ֲ�����ȥ����

��д����Ӧ�ڵ����ӷ���ʽ,����˫���ŷ���ʾ����ת�Ƶķ������Ŀ_________;
������ҺC�м���BaCl2��Һ,�а�ɫ��������,�����ӷ���ʽΪ____________;��Ӧ�۵Ļ�ѧ����ʽΪ______________________________��
���𰸡�+3 Fe(OH)2 ���� Fe2+��Na+ Fe+Cu2+= Fe2++Cu��˫���� SO42-+Ba2+=BaSO4�� CuSO4+2NaOH=Cu(OH)2��+Na2SO4
SO42-+Ba2+=BaSO4�� CuSO4+2NaOH=Cu(OH)2��+Na2SO4
��������
(1)���ݻ������л��ϼ۴�����Ϊ���ԭ��Fe(OH)3����Ԫ�ػ��ϼ�Ϊ +3���ڷ�Ӧ��Ԫ�ػ��ϼ����ߵ���������ԭ�����ڸ�������Ӧ�л�ԭ����Fe(OH)2��
��2��ʵ���������������Һ�����IJ����������ˣ���Һ���к��е������У���Ӧ���ɵ�����������ԭ�����Ȼ��ƣ�����û�з�Ӧ�����ᣬ��Һ����һ�����еĽ�����������Fe2+��Na+��
ʵ������������ͭ���ӷ�Ӧ�����������Ӻ͵���ͭ����˫���ŷ���ʾ����ת�Ƶķ������ĿΪ�� ��
��
������ͭ���Ȼ�����Ӧ���������ᱵ�������Ȼ�ͭ����Ӧ�Ļ�ѧ����ʽΪ��BaCl2+CuSO4�TBaSO4��+CuCl2�������ӷ���ʽΪSO42-+Ba2+=BaSO4������Ӧ����������������ͭ��Ӧ���������ƺ�������ͭ�������䷴Ӧ����ʽΪ��2NaOH+CuSO4�TNa2SO4+Cu��OH��2����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ּ������м�ȩ(HCHO)�����ĵ绯ѧ�������Ĺ���ԭ����ͼ��ʾ������˵����ȷ����

A. ����������ʱ�������缫���Ƹ�
B. ����ʱ��H+ͨ������Ĥ�����缫�����ƶ�
C. ��������ͨ��1.2��l0-6 mol���ӣ����봫�����ļ�ȩΪ3��10-3 mg
D. ����ʱ���Ե缫���������Һ��pH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ŵ������������Ľ�ʹ��ѡ��ҩ����ŵ຺ϳ�·�����£�

��1����ŵ��к��������ţ�����������-NHCO-���⣬�����ֹ��������ƣ�___��____��
��2��д��������������A��ͬ���칹�����Ŀ_____��������FeCl3��Һ������ɫ��Ӧ����1mol�÷��ӿ���2molNaOH��Ӧ��
��3������ŵ຺ϳ�·�ߵõ���ʾ�����ü���ױ���ClCH2COCl��(C2H5)NH�����Լ����ã��ϳ�������������ں����ϲ��䷴Ӧ��ڷ����ڲ��������_____��_____��_____��_____��_____��_____��

���������
��֪��![]()

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ⱥ��ʳ��ˮģ��װ�õĽṹ��ͼ��ʾ��


��1��д����ⱥ��ʳ��ˮ�Ļ�ѧ����ʽ____���ù�ҵ��___��ҵ��
��2��ʵ��������ʹ�õ�����������һЩ���ʣ��ڵ��ʳ��ˮ֮ǰ����Ҫ�ᴿʳ��ˮ��Ϊ�˳�ȥ�����е�Ca2+��Mg2+��SO42������ɳ���ɽ���������ˮ��Ȼ�������������������ٹ��� �ڼӹ�����NaOH��Һ �ۼ����������� �ܼӹ�����Na2CO3��Һ �ݼӹ�����BaCl2��Һ��������ȷ��˳����____��ѡ����ĸ��
a���٢ܢڢݢ� b���ݢڢܢ٢� c���ڢݢܢ٢� d���ݢڢܢۢ�
��3���ڸ�װ����д��װNaOH��Һ�Թ����������Ļ�ѧ��Ӧ����ʽ_____��
��4����ҵ����____��д�������ƣ��͵�����____��Ӧ���Ƶ�Ư�۾��� Ư�۾����ڷ����ڿ�������ʧЧ��ԭ���ǣ��û�ѧ����ʽ��ʾ��___��____��
��5����ҵ�������ֵ���������ͼ�ϳ����кϳ��Ȼ��⣬A��ͨ��___��B��ͨ��___�����Ȼ�������ˮ�м��ɵõ����ᣬ����뷽��ʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л��������ۼ���ϩ��������������ʸߡ������ᡢ��ȫ���ܸߵ��ŵ㣬Ŀǰ���㷺�������������DZ�������������֡���ѧ��Ƭ�����ݶ����绰ͤ�������䡢��־�Ƶȡ�
��ͼ����2������ϩΪԭ�Ϻϳ��л�����E������2������ϩ���������·�ߣ�
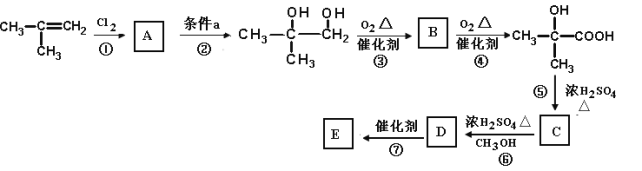
(1)�л������� �к��еĹ�����������_____________________________________��
�к��еĹ�����������_____________________________________��
(2)д��B�Ľṹ��ʽ��___________________________________
(3)д����Ӧ�ٵĻ�ѧ����ʽ____________________________________________________________________
(4)д����Ӧ�Ļ�ѧ����ʽ__________________________________________________________________
(5)�������� ~ ��Ӧ�У�����ȡ����Ӧ����______________�����ڼӳɷ�Ӧ����___________��
(6)д��E�Ľṹ��ʽ��___________________________
(7)д���л��� ͨ�������γɸ߷��Ӿ���F�Ľṹ��ʽ��___________________________
ͨ�������γɸ߷��Ӿ���F�Ľṹ��ʽ��___________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л���ѧ���������ȩF (![]() )����Ȼ������ڹ����У���һ�ֳ��õ�ֲ���ζ�ͣ���ҵ����Ҫ�ǰ�����·�ߺϳɵģ�
)����Ȼ������ڹ����У���һ�ֳ��õ�ֲ���ζ�ͣ���ҵ����Ҫ�ǰ�����·�ߺϳɵģ�

��֪������ȩ������NaOH��Һ�����¿��Է�����Ӧ������һ���ǻ�ȩ��
![]() +
+![]()
![]()
![]()
��ش�
��1��D�Ľṹ��ʽΪ ���������й����ŵ��Լ�Ϊ ��
��2����Ӧ�����������ڼӳɷ�Ӧ���� ������ţ���
��3��д���йط�Ӧ���Ļ�ѧ����ʽ�� ��
��4����ʵ�����������![]() �������е���Ԫ��ʱ���ǽ����е���Ԫ��ת��ΪAgCl��ɫ���������еģ�����ȷ�IJ��������� ���밴ʵ�鲽��������Ⱥ������д��ţ���
�������е���Ԫ��ʱ���ǽ����е���Ԫ��ת��ΪAgCl��ɫ���������еģ�����ȷ�IJ��������� ���밴ʵ�鲽��������Ⱥ������д��ţ���
A���μ�AgNO3��Һ | B����NaOH��Һ | C������ | D����ϡ�����ữ |
��5�����й���E��˵����ȷ���� ������ĸ����
a������������Һ��Ӧ b����������Ʒ�Ӧ
c��1 mol E����ܺ�3 mol������Ӧ d�����Է���ˮ��
��6��E��ͬ���칹���ж��֣�����֮һ������������������ֻ��һ��ȡ���������������࣬����H�ͷ�����G�Ƶã��ֲ��H���ӵĺ�����ͺ˴Ź�����������ͼ������֪H����Է�����Ϊ32����Ľṹ��ʽΪ
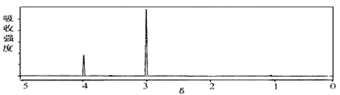
δ֪��H�ĺ˴Ź�������

δ֪��H�ĺ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش���������
ѧ���е�ƽ��������Ҫ��������ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ�����֣��Ҿ�������������ԭ����ش��������⣺
(1)�����£�ij������Һ�е����̪����Һ�ʺ�ɫ�������Һ�� ______�ԣ�ԭ����________________�������ӷ���ʽ��ʾ
(2)�ڳ����½�pH=2������10mL��ˮϡ�͵�1L����ϡ�ͺ����Һ��pHֵ���� ______________��
(3)��֪��H2S��Һ�д�������ƽ�⣺ H2S![]() H++HS-
H++HS-
��H2S��Һ�м���NaOH����ʱ���������¶ȱ仯����ƽ����______�ƶ�������������������)��c(H+)______��(����������������С������������
��H2S��Һ�м���NaHS����ʱ������ƽ����______�ƶ�������������������)c(S2��)______��(����������������С������������)

(4)�����£�ȡpH=2������ʹ�����Һ��100mL�������зֱ����������Zn������Ӧ����������Һ��pH�仯��ͼ��ʾ����ͼ�б�ʾ������Һ��pH�仯���ߵ��� ______ ����A������B�����������м����Zn����Ϊm1��������Һ�м����Zn����Ϊm2����m1______ m2�� (ѡ����![]() ������
������![]() ������
������![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����(����)
A. CH4��C2H2��HCN���Ǻ��м��Լ��ķǼ��Է���
B. CO2��SO2�����幹�����ƣ����ǷǼ��Է���
C. ![]() �����к���1������̼ԭ��
�����к���1������̼ԭ��
D. ��������������м�����ԭ�ӣ��������ڼ�Ԫ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com