
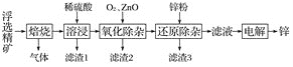
【题目】我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
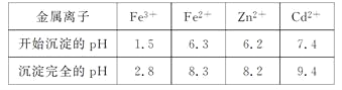
相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为__________。
(2)滤渣1的主要成分除SiO2外还有________;氧化除杂工序中ZnO的作用是_____________,若不通入氧气,其后果是___________。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为__________。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为__________;沉积锌后的电解液可返回________工序继续使用。
【答案】2ZnS+3O2![]() 2ZnO+2SO2 PbSO4 调节溶液的pH 无法除去杂质Fe2+ Cd2++Zn===Cd+Zn2+ Zn2++2e-===Zn 溶浸
2ZnO+2SO2 PbSO4 调节溶液的pH 无法除去杂质Fe2+ Cd2++Zn===Cd+Zn2+ Zn2++2e-===Zn 溶浸
【解析】
焙烧时,硫元素转化为二氧化硫,然后用稀硫酸溶浸,生成硫酸锌,硫酸亚铁和硫酸镉,二氧化硅与稀硫酸不反应转化为滤渣,因硫酸铅不溶于水,故滤渣1中还含有硫酸铅。由于沉淀亚铁离子的pH较大,需要将其氧化为铁离子,通过控制pH得到氢氧化铁沉淀;滤液中加入锌粉置换出镉,最后将滤液电解得到金属锌,据以上分析进行解答。
(1)闪锌矿的主要成分ZnS在高温下易被氧气氧化,得到产物ZnO和SO2;
故答案为:2ZnS+3O2![]() 2ZnO+2SO2;
2ZnO+2SO2;
(2)PbS在高温下与氧气反应生成PbO与SO2,PbO与酸反应生成难溶于酸的PbSO4,故滤渣1中还有PbSO4;由金属离子形成氢氧化物沉淀的pH可知,需要将Fe2+转化为Fe3+,生成Fe(OH)3沉淀除去,故加入ZnO与溶液中的H+反应,调节溶液pH来沉淀Fe3+;若不通入氧气,则无法将Fe2+转化为Fe3+,完全沉淀Fe2+时Zn2+也会被沉淀。
故答案是:PbSO4;调节溶液的pH;无法除去杂质Fe2+;
(3)Zn将Cd2+还原为Cd单质:Cd2++Zn===Cd+Zn2+;
故答案是:Cd2++Zn===Cd+Zn2+;
(4)电解硫酸锌溶液,阴极发生反应的是溶液中的Zn2+,反应式为:Zn2++2e-=Zn;阳极发生反应的物质为水电离出的OH-,极反应:2H2O-4e-=O2+4H+,反应后电解液中剩余离子为氢离子和硫酸根,故可循环参与过程中的溶浸。
故答案是:Zn2++2e-===Zn;溶浸。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业电解饱和食盐水模拟装置的结构如图所示:


(1)写出电解饱和食盐水的化学方程式____,该工业称___工业。
(2)实际生产中使用的盐往往含有一些杂质,在电解食盐水之前,需要提纯食盐水。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,①过滤 ②加过量的NaOH溶液 ③加适量的盐酸 ④加过量的Na2CO3溶液 ⑤加过量的BaCl2溶液,操作正确的顺序是____(选填字母)
a.①④②⑤③ b.⑤②④①③ c.②⑤④①③ d.⑤②④③①
(3)在该装置中写出装NaOH溶液试管中所发生的化学反应方程式_____。
(4)工业上用____(写物质名称)和电解产物____反应可制得漂粉精, 漂粉精敞口放置于空气中易失效,原因是(用化学方程式表示)___、____。
(5)工业上用两种电解产物在如图合成塔中合成氯化氢,A处通入___,B处通入___,后将氯化氢溶于水中即可得到盐酸,其电离方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于燃料充分燃烧的说法,不正确的是 ( )
A. 空气量越多越好B. 应通入适量空气
C. 固体燃料燃烧前要粉碎D. 液体燃料燃烧时可以以雾状喷出
查看答案和解析>>
科目:高中化学 来源: 题型:
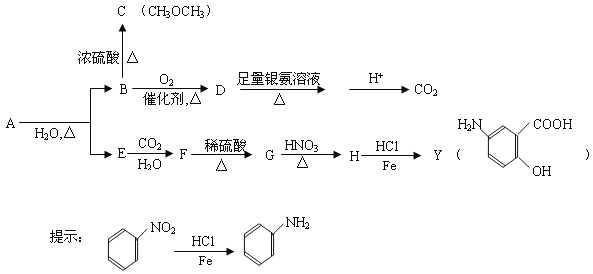
【题目】【化学-有机化学基础】利用从冬青中提取的有机物A合成结肠炎药物及其它化学品,合成路线如下:
根据上述信息回答:
(1)D不与NaHCO3溶液反应,D中官能团的名称是__________。B→C的反应类型是______。
(2)写出A生成B和E的化学反应方程式__________________。
(3)A的同分异构体I和J是重要的医药中间体,在浓硫酸的作用下I和J分别生成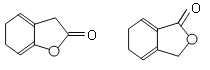 ,鉴别I和J的试剂为______________________。
,鉴别I和J的试剂为______________________。
(4)A的另一种同分异构体K用于合成高分子材料K可由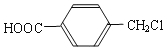 制得,写出K在浓硫酸作用下生成的聚合物的结构简式:__________________。
制得,写出K在浓硫酸作用下生成的聚合物的结构简式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用1.0mol/L的NaOH溶液中和某浓度的H2SO4溶液,其水溶液的pH和所用NaOH溶液的体积变化关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )
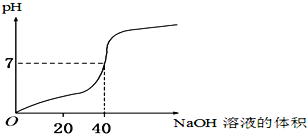
A.1.0 mol/L,20 mL B.0.5 mol/L,40 mL
C.0.5 mol/L,80 mL D.1.0 mol/L,80 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. CH4,C2H2,HCN都是含有极性键的非极性分子
B. CO2与SO2的立体构型相似,都是非极性分子
C. ![]() 分子中含有1个手性碳原子
分子中含有1个手性碳原子
D. 无机含氧酸分子中有几个氢原子,它就属于几元酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A. 10 gD2O中含有的质子数与中子数均为5NA
B. 标准状况下,22.4LCHC13中含C-Cl键的数目为3NA
C. 密闭容器中,1mol NH3和1molHCl反应后气体分子总数为NA
D. l00mL1.0 mol/L FeC13溶液与足量Cu反应,电子转移数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某次实验中预计需要使用480 mLamol/L的纯碱溶液,下面是某同学在实验室配制该溶液的流程图,回答下列问题:


(1)流程图中的配制过程少了一步,请指出缺少的步骤是_____________。
(2)最合适的V值为________,由此值求出的a=________,使用容量瓶前对容量瓶必须进行的一项操作是______________________。
(3)所给出的流程图中体现出的操作内容有三个错误,请写出:_____________、___________、____________________。
(4)指出下列实验操作对结果以及对所配制溶液浓度的影响,填写“偏大”“偏小”或者“无影响”。
①转移溶液时容量瓶中有少量的蒸馏水:________;
②定容时俯视刻度线:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】巴豆酸的结构简式为CH3-CH=CH-COOH。现有①氯化氢;②溴水;③纯碱溶液;④丁醇;⑤酸性高锰酸钾溶液。试根据巴豆酸的结构特点,判断在一定条件下,能与巴豆酸反应的物质是
A.②④⑤B.①③④C.①②③④D.①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com