
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A. 10 gD2O中含有的质子数与中子数均为5NA
B. 标准状况下,22.4LCHC13中含C-Cl键的数目为3NA
C. 密闭容器中,1mol NH3和1molHCl反应后气体分子总数为NA
D. l00mL1.0 mol/L FeC13溶液与足量Cu反应,电子转移数为0.2NA
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是________,操作②的名称是____________。
(2)试剂a是____________(填化学式,下同),试剂b是__________,固体B是____________。
(3)加入试剂a所发生反应的化学方程式为__________________________________。
加入试剂b所发生反应的化学方程式为____________________________________。
(4)该方案能否达到实验目的:__________________________(填“能”或“不能”)。若不能,应如何改进?(若能,此问不用回答)__________。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是____的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
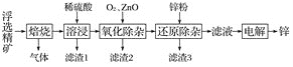
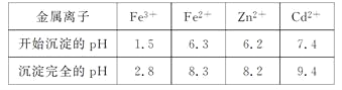
相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为__________。
(2)滤渣1的主要成分除SiO2外还有________;氧化除杂工序中ZnO的作用是_____________,若不通入氧气,其后果是___________。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为__________。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为__________;沉积锌后的电解液可返回________工序继续使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用乙苯![]() 经催化脱氢生产苯乙烯
经催化脱氢生产苯乙烯![]() ,下列说法错误的是
,下列说法错误的是
A. 乙苯可通过石油催化重整获得
B. 乙苯的同分异构体超过四种
C. 苯乙烯与氯化氢反应可生成氯代苯乙烯
D. 乙苯和苯乙烯分子所有碳原子均可处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中的中心原子杂化轨道的类型相同的是( )
A. CO2与SO2 B. CH4与NH3 C. BeCl2与BF3 D. C2H2与C2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在科学研究和化工生产等领域都有着广泛的应用。请回答下列问题:
(1)与氮元素同族的第四周期元素的基态原子价层电子轨道表达式为___________。
(2)尿素分子的结构简式为:CO(NH2)2,该分子中σ键数目为___________,实验测得:分子中的所有原子在同一平面内,尿素中的碳氧键(125pm)比典型的碳氧双键(121pm)长,而尿素中的碳氮键(137pm)比典型的碳氮单键(147pm)短,说明分子中存在____________。
(3)氨分子构型为_________,氨晶体中,氨分子中的每个H 均参与一个氢键的形成,1 mol固态氨中有_____mol氢键。
(4)通常认为Cu3N是离子晶体,其晶格能可通过图(a)的Born-Haber循环计算得到。

可知, Cu原子的第一电离能为_____kJmol1,N≡N键键能为_____kJmol1,Cu3N晶格能为_____kJmol1。
(5)Cu3N晶体的晶胞如图(b)所示。晶胞边长为anm,晶胞中N3- 位于Cu+所形成的正八 面体的体心,该正八面体的边长为____nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.25mol的气态高能燃料乙炔(C2H2)在氧气中完全燃烧,生成气态CO2和气态水,放出389kJ,则其热化学方程式为____。
(2)又知H2O(l)→H2O(g)-44kJ,则22.4L(标准状况)乙炔气体完全燃烧生成液态水时放出的热量是___kJ;若将足量的氧气与39g乙炔气体充分反应,实际只有2000kJ的能量被有效利用,则此时能量的利用率为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com