
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是________,操作②的名称是____________。
(2)试剂a是____________(填化学式,下同),试剂b是__________,固体B是____________。
(3)加入试剂a所发生反应的化学方程式为__________________________________。
加入试剂b所发生反应的化学方程式为____________________________________。
(4)该方案能否达到实验目的:__________________________(填“能”或“不能”)。若不能,应如何改进?(若能,此问不用回答)__________。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是____的质量。
【答案】溶解 过滤 K2CO3 HCl BaCl2 K2CO3+BaCl2BaCO3↓+2KCl BaCO3+2HClBaCl2+ CO2↑+ H2O 不能 应在操作②的滤液中加入过量盐酸后再蒸发结晶 沉淀A1或固体B
【解析】
试题(1)将固体混合物形成溶液的操作为溶解;操作②是将固体和溶液分离,为过滤。(2分离氯化钾和氯化钡,应将氯化钡转化为沉淀而分开,所以先加入碳酸钾,生成碳酸钡沉淀,所以试剂a为碳酸钾,沉淀A为碳酸钡,洗涤后加入盐酸,碳酸钡和盐酸反应生成氯化钡,再蒸发结晶即可得B氯化钡,所以试剂b为盐酸。滤液为氯化钾。(3) 加入碳酸钾,氯化钡和碳酸钾反应生成碳酸钡沉淀和氯化钾,方程式为K2CO3+BaCl2=BaCO3↓+2KCl;碳酸钡和盐酸反应生成氯化钡和水和二氧化碳,方程式为BaCO3+2HCl= BaCl2+CO2↑+H2O。(4)因为加入了碳酸钾,所以滤液中有碳酸钾,直接蒸发结晶有碳酸钾杂质,应在操作②的滤液中加入过量盐酸后再蒸发结晶。(5)要的定氯化钾或氯化钡的质量分数,需要知道氯化钾或氯化钡的质量,所以需要获得的数据有沉淀A1或固体B。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】工业上主要采用软锰矿和闪锌矿联合生产MnO2和锌。软锰矿主要成分为MnO2;还含少量Al2O3和SiO2杂质。闪锌矿主要成分为ZnS,还含少量FeS、CuS杂质。现用稍过量的软锰矿和闪锌矿为原料,经过一系列处理后分别在两个电极生成产品“MnO2和锌”。工艺流程如下:
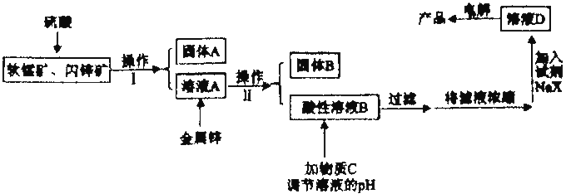
已知:Ⅰ:金属硫化物、硫酸、二氧化锰三者发生的反应均是氧化还原反应。
例如:MnO2+ZnS+2H2SO4![]() MnSO4+ZnSO4+S+2H2O.
MnSO4+ZnSO4+S+2H2O.
Ⅱ:4X-+Mn2+![]() MnX42-,X-不参与电极反应。Zn2+与X-不反应。
MnX42-,X-不参与电极反应。Zn2+与X-不反应。
Ⅲ:各种金属离子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | A13+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)操作I的名称是_____________________。
(2)物质C是MnO2和ZnO的混合物。加入物质C充分作用后,过滤,所得固体的成分是________(用化学式表示)。
(3)电解溶液D的装置如下图所示,两个电极都是惰性电极。
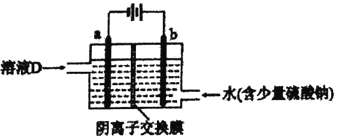
①硫酸钠的作用是________________________。
②b电极的电极反应式是______________________。a电极的电极反应式是_______________________。
(4)若一定质量的闪锌矿中含1.76kgFeS,则在上述流程中1.76kgFeS消耗MnO2的质量为_______kg。
(5)现有0.4mol/L Mn(NO3)2、 0.8mol/LZn(NO3)2的混合溶液100mL,向该混合液中逐滴加入Na2S溶液,当MnS沉淀一定程度时,测得c(Mn2+)=2.0×10-3 mol/L,则此时c(Zn2+)=________[已知Ksp(ZnS)=1.3×10-24,Ksp(MnS)=2.6×10-13]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于元素周期表结构的叙述中,正确的是
A.7个横行代表7个周期,18个纵行代表18个族
B.副族元素中没有非金属元素
C.除第一周期外,其他周期均有18种元素
D.碱金属元素是指ⅠA族的所有元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示实验,判断下列叙述错误的是

A. 如图所示实验能够证明碳酸的酸性强于硅酸
B. 如图所示实验可证明元素的非金属性:Cl>C>Si
C. 如图所示实验中没有可以设计原电池的化学反应
D. 如图实验开始前需要打开分液漏斗的上口瓶塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构与H2O2类似,熔点为193K,沸点为411K,遇水很容易水解,产生的气体能使品红褪色,S2Cl2可由干燥氯气通入熔融的硫中制得。下列有关说法正确的是
A. S2Cl2的电子式为![]()
B. 固态时S2Cl2属于原子晶体
C. S2Cl2与NaOH的化学方程式可能为:S2Cl2+6NaOH=2NaCl+Na2SO3+Na2S+3H2O
D. S2Cl2是含有极性键和非极性键的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α-鸢尾酮香料的分子结构如图,下列说法不正确的是
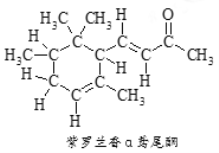
A. α-鸢尾酮可与某种酚互为同分异构体
B. 1 mol α-鸢尾酮最多可与3molH2加成
C. α-鸢尾酮能发生银镜反应
D. α-鸢尾酮经加氢→消去→加氢三步反应可转变为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,22.4LCCl4所含分子数为NA
B. 28g CO和N2的混合气体所含的原子数为NA
C. 2mol金属铁与足量的盐酸反应,共失去了 4NA个电子
D. 124g白磷(分子式为P4)所含分子数为4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com