
【题目】反应![]() 在一个密闭容器中进行,下列措施可以使反应速率增大的是( )
在一个密闭容器中进行,下列措施可以使反应速率增大的是( )
①增加少量![]() ②升高温度③体积不变,再通入
②升高温度③体积不变,再通入![]() ④缩小体积增大压强⑤体积不变,再通入He⑥压强不变,再通入He
④缩小体积增大压强⑤体积不变,再通入He⑥压强不变,再通入He
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
科目:高中化学 来源: 题型:
【题目】(1)试管Ⅰ和Ⅱ中分别加入3 mL稀盐酸(均足量),再将装0.3 g NaHCO 3和0.3 g Na2CO3粉末的小气球分别套在试管Ⅰ和Ⅱ的管口。将气球内的 NaHCO3和Na2CO3同时倒入试管中,请回答下列问题:

①试管Ⅰ中发生反应的离子方程式为________。
②加入固体后,试管_______(填 “Ⅰ”或“Ⅱ”)上的气球膨胀较快。
(2)为研究Na2CO3、NaHCO3与盐酸的反应是吸热反应还是放热反应,某同学继续进行了下列实验(每次实验各做3次平行实验,取平均值):
序号 | 35 mL试剂 | 固体 | 混合前温度/℃ | 混合后温度/℃ |
① | 水 | 2.5 g NaHCO3 | 20.0 | 18.5 |
② | 水 | 3.2 g Na2CO3 | 20.0 | 24.3 |
③ | 盐酸 | 2.5 g NaHCO3 | 20.0 | 16.2 |
④ | 盐酸 | 3.2 g Na2CO3 | 20.0 | 25.1 |
①设计1、2组实验的目的是:_______。
②通过上述实验可得出:NaHCO3溶液和盐酸的反应是_____反应,对应的图像为______。
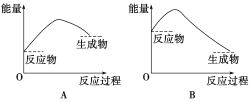
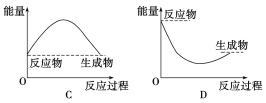
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是熔点最高的金属,是重要的战略物资。自然界中钨主要存在于黑钨矿中,其主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、As的化合物。由黑钨矿冶炼钨的工艺流程如下:
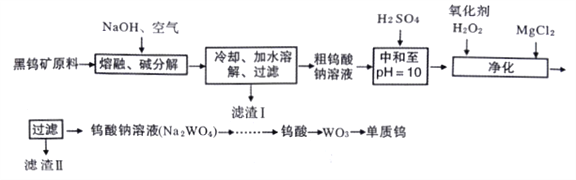
已知:
①滤渣I的主要成份是Fe2O3、MnO2。
②上述流程中,钨的化合价只有在最后一步发生改变。
③常温下钨酸难溶于水。
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为____,请写出MnWO4在熔融条件下发生碱分解反应生成Fe2O3的化学方程式__________。
(2)上述流程中向粗钨酸钠溶液中加硫酸中和至pH=10后,溶液中的杂质阴离子确SiO32-、HAsO32-、HAsO42-等,则“净化”过程中,加入H2O2时发生反应的离子方程式为____,滤渣Ⅱ的主要成分是____。
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。下图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则:
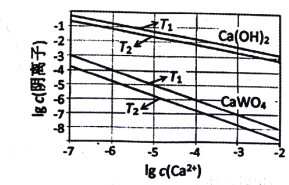
①T1 _____T2(填“>”或“<”)T1时Ksp(CaWO4)=____。
②将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 0.1 mol·L-1 KSCN溶液中:Fe3+、NH4+ 、Br-、SO42 -
B. ![]() =106的溶液中:NH4+ 、K+、AlO2- 、NO3-
=106的溶液中:NH4+ 、K+、AlO2- 、NO3-
C. 能使甲基橙变红的溶液中:Cu2+、Mg2+、SO42 -、Cl-
D. 0.1 mol·L-1 Ca(NO3)2溶液中:Na+、NH4+ 、CO32 -、CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2的漂白能力是漂白粉的4~5倍, NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
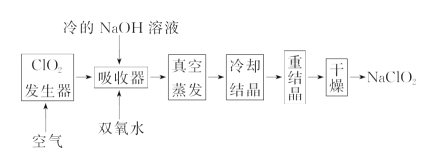
(1)ClO2气体发生器中的反应为:2NaClO3+SO2+H2SO4===2ClO2+2NaHSO4。实际工业生产中,可用硫黄、浓硫酸代替原料中的SO2,其原因为____________(用化学方程式表示)。
(2)反应结束后,向ClO2发生器中通入一定量空气的目的:________________________。
(3)吸收器中生成NaClO2的离子反应方程式为________________________________。
(4)CO和联氨(N2H4)的性质及应用的研究是能源开发、环境保护的重要课题。
①用CO、O2和KOH溶液可以制成碱性燃料电池,则该电池反应的离子方程式为_______________。
②用CO、O2和固体电解质还可以制成如下图所示的燃料电池,则电极d的电极反应式为__________。
(5)联氨的性质类似于氨气,将联氨通入CuO浊液中,有关物质的转化如图所示。
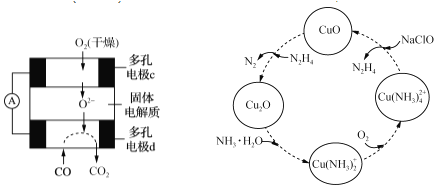
①在转化过程中通入氧气发生反应后,溶液的pH将________(填“增大”、“减小”或“不变”)。转化中当有1 mol N2H4参与反应时,需要消耗O2的物质的量为________。
②加入NaClO时发生的反应为:
Cu(NH3)42++2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
该反应需在80℃以上进行,其目的除了加快反应速率外,还有_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中![]() 下列分析正确的是
下列分析正确的是![]()
![]()

A. ![]() 闭合,铁棒上发生的反应为
闭合,铁棒上发生的反应为![]()
B. ![]() 闭合,石墨棒周围溶液pH逐渐降低
闭合,石墨棒周围溶液pH逐渐降低
C. ![]() 闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D. ![]() 闭合,电路中通过
闭合,电路中通过![]() 个电子时,两极共产生
个电子时,两极共产生![]() 气体
气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关乙烯和乙烷的说法中错误的是![]()
![]()
A. 乙烯是平面分子,乙烷分子中所有原子不可能在同一平面内
B. 溴的四氯化碳溶液和酸性![]() 溶液都可以鉴别乙烯和乙烷
溶液都可以鉴别乙烯和乙烷
C. 溴的四氯化碳溶液和酸性![]() 溶液都可以除去乙烷中混有的乙烯
溶液都可以除去乙烷中混有的乙烯
D. 乙烯的化学性质比乙烷的化学性质活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氟化氮![]() 是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和
是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和![]() ,请根据要求回答下列问题:
,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素原子的物质的量之比为 ______ .
(2)写出该反应的化学方程式 ______ ![]() 若反应中生成
若反应中生成![]()
![]() ,转移的电子数目为 ______ 个
,转移的电子数目为 ______ 个![]()
(3)![]() 是一种无色、无臭的气体,但一旦
是一种无色、无臭的气体,但一旦![]() 在空气中泄漏,还是易于发现
在空气中泄漏,还是易于发现![]() 你判断该气体泄漏时的现象是 ______ .
你判断该气体泄漏时的现象是 ______ .
(4)一旦![]() 泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除
泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除![]() 、NaF、
、NaF、![]() 外,还肯定有 ______
外,还肯定有 ______ ![]() 填化学式
填化学式![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0.6molFeBr2溶液中通入amolCl2。下列叙述不正确的是( )
A. 当a=0.2时,发生的反应为:2Fe2++Cl2=2Fe3++2Cl-
B. 当a=0.9时,发生的反应为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C. 若溶液中Br- 有一半被氧化时,c(Fe3+):c(Br-):c(Cl-)=l:1:3
D. 当0<a<0.3时,溶液中始终满足2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com