
����Ŀ����0.6molFeBr2��Һ��ͨ��amolCl2��������������ȷ���ǣ� ��
A. ��a=0��2ʱ�������ķ�ӦΪ:2Fe2++Cl2=2Fe3++2Cl-
B. ��a=0��9ʱ�������ķ�ӦΪ��2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C. ����Һ��Br- ��һ�뱻����ʱ��c(Fe3+):c(Br-):c(Cl-)=l:1:3
D. ��0<a<0��3ʱ����Һ��ʼ������2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+c(OH-)
���𰸡�C
��������
���ӻ�ԭ��Fe2+��Br-�����ȷ�����2Fe2++Cl2=2Fe3++2Cl-��Fe2+��Ӧ����ٷ�����2Br-+Cl2�TBr2+2Cl-�����ݱ�����ϵȷ���μӷ�Ӧ���������ʵ�����ϵ��������д�ܵ����ӷ���ʽ���м���ȷ����
���ӻ�ԭ��Fe2+��Br-�����ȷ�����2Fe2++Cl2=2Fe3++2Cl-��Fe2+��Ӧ����ٷ�����2Br-+Cl2�TBr2+2Cl-���ٵ�![]() =1ʱ��Fe2+ȫ����������Br-��Fe2+��2����ֻ��һ���Br-�������ԣ���Ӧ���ӷ���ʽΪ��2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-���ڵ�
=1ʱ��Fe2+ȫ����������Br-��Fe2+��2����ֻ��һ���Br-�������ԣ���Ӧ���ӷ���ʽΪ��2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-���ڵ�![]() ��
��![]() ʱ��Fe2+��Br-ȫ������������Ӧ���ӷ���ʽΪ��2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-��A��a = 0.2ʱ, Cl2���㣬��������Fe2+��Ӧ��������Ӧ�����ӷ���ʽ��ȷ��B��a = 0.9ʱ��Cl2ǡ����FeBr2��Ӧ�������ķ�Ӧ�����ӷ���ʽ��ȷ��C������Һ��Br����һ�루0.6mol��������ʱ����ʱ0.6mol Fe2+��Ҫ����0.3mol��0.6molBr����Ҫ����0.3mol����������0.6mol�����������غ㶨�ɣ�������Һ��c(Fe3+): c(Br��):c(Cl��)=1:1:2���ʲ���ȷ��D��0��a��0.3ʱ��Fe2+δ��ȫ����������Һ�л�����Fe2+�����ݵ���غ㶨�ɣ�2c(Fe2+)+3c(Fe3+)+c(H+)��c(Cl��)+c(Br��)+ c(OH��)��������ȷ����ѡC��
ʱ��Fe2+��Br-ȫ������������Ӧ���ӷ���ʽΪ��2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-��A��a = 0.2ʱ, Cl2���㣬��������Fe2+��Ӧ��������Ӧ�����ӷ���ʽ��ȷ��B��a = 0.9ʱ��Cl2ǡ����FeBr2��Ӧ�������ķ�Ӧ�����ӷ���ʽ��ȷ��C������Һ��Br����һ�루0.6mol��������ʱ����ʱ0.6mol Fe2+��Ҫ����0.3mol��0.6molBr����Ҫ����0.3mol����������0.6mol�����������غ㶨�ɣ�������Һ��c(Fe3+): c(Br��):c(Cl��)=1:1:2���ʲ���ȷ��D��0��a��0.3ʱ��Fe2+δ��ȫ����������Һ�л�����Fe2+�����ݵ���غ㶨�ɣ�2c(Fe2+)+3c(Fe3+)+c(H+)��c(Cl��)+c(Br��)+ c(OH��)��������ȷ����ѡC��


 �ο�������ϵ�д�
�ο�������ϵ�д� ������ѧ��ʱ��ҵϵ�д�
������ѧ��ʱ��ҵϵ�д� ���������ʱ��ѵϵ�д�
���������ʱ��ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ![]() ��һ���ܱ������н��У����д�ʩ����ʹ��Ӧ����������ǣ� ��
��һ���ܱ������н��У����д�ʩ����ʹ��Ӧ����������ǣ� ��
����������![]() �������¶Ȣ�������䣬��ͨ��
�������¶Ȣ�������䣬��ͨ��![]() ����С�������ѹǿ��������䣬��ͨ��He��ѹǿ���䣬��ͨ��He
����С�������ѹǿ��������䣬��ͨ��He��ѹǿ���䣬��ͨ��He
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CO2��H2��CO��ɵĻ������ͬ��ͬѹ���뵪�����ܶ���ͬ����û������CO2��H2��CO��������ǣ� ��
A. 26:8:1 B. 22:1:14 C. 13:8:7 D. 26:6:17
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��������ܻᵼ��ʵ����ƫ�ߵ��ǣ� ��
A. ����һ�����ʵ���Ũ�ȵ���Һ����Һ��δϴ���ձ�
B. ����һ�����ʵ���Ũ�ȵ���Һ������ʱ���ӿ̶���
C. ����һ�����ʵ���Ũ��ϡ����ʱ������Ͳ��ȡŨ����ʱ���Ӷ���
D. ��Ũ�������ռ��ϡ��Һ��Ӧ���ⶨ�к��ȵ���ֵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ϲ��ؾ��п��������ס��������������������ã����Ľṹ��ʽ��ͼ��ʾ�������й������ϲ��ص�˵����ȷ����

A. �÷����к���1������̼ԭ��
B. 1mol�����ϲ���������2mol NaOH��Ӧ
C. 1mol �����ϲ���������2mol Br2��Ӧ
D. ����FeCl3��Һ������ɫ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Ԫ�����ڱ���������ȷ���ǣ� ��
A. ��7�����ڣ�18����
B. ��IA��Ԫ��Ҳ��Ϊ�����Ԫ��
C. Ԫ������������Ϊ��IIIB��
D. Ԫ�����ڱ���ÿ�����ھ��ӽ���Ԫ�ؿ�ʼ���Էǽ���Ԫ�ؽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z��ԭ��������������m��p��q��r��s������ЩԪ����ɵĶ�Ԫ��������³�ѹ��rΪҺ�壬�����Ϊ��ɫ���塣m��Ħ������Ϊp��2����n��Ԫ��Y�ĵ��ʣ�����ɫֲ�������ò�������ɫ���壻p������ʹʪ��ĺ�ɫʯ����ֽ������q��ʹƷ����Һ��ɫ���������ʵ�ת����ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��
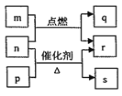
A. q��s������������
B. Z�ĺ�������һ��ǿ��
C. X��Y�ֱ���W�γ�10e-�����ܷ�Ӧ����һ������
D. ԭ�Ӱ뾶��X��Y��Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ�����ʾ��ȷ���� �� ��
A. 35Cl��37Cl��ԭ�ӽṹʾ��ͼ��Ϊ![]()
B. HC1O�ĵ���ʽ��![]()
C. CO2�ı���ģ�ͣ� ![]()
D. ��ϩ�Ľṹʽ��CH2=CH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�У����ʵ����ʵ���Ũ��Ϊ1mol/L���ǣ� ��
A. ��Na+Ϊ2mol��Na2SO4��Һ
B. ��80g SO3����ˮ�����1L����Һ
C. ��0.5mol/L��ij������Һ100mL������������50gˮ�����Һ
D. ��58.5gNaCl����1Lˮ���õ���Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com