
【题目】乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法正确的是

A. 该分子中含有1个手性碳原子
B. 1mol乙酰紫草素最多可与2mol NaOH反应
C. 1mol 乙酰紫草素最多可与2mol Br2反应
D. 能与FeCl3溶液发生显色反应
【答案】AD
【解析】本题主要是考查有机物结构和性质,A.该分子中只有连接酯基中-COO-的碳原子是手性碳原子,所以只有1个手性碳原子;B.能和氢氧化钠反应的有酚羟基、酯基水解生成的羧基,所以1mol乙酰紫草素最多可与3molNaOH反应;C.能和溴发生加成反应的有碳碳双键,苯环上酚羟基邻位氢原子能被溴取代,所以1mol 乙酰紫草素最多可与4molBr2反应;D.含有酚羟基,能发生显色反应。
A.该分子中只有连接酯基中-COO-的碳原子是手性碳原子,所以只有1个手性碳原子,A正确;
B.能和氢氧化钠反应的有酚羟基、酯基水解生成的羧基,所以1mol乙酰紫草素最多可与3molNaOH反应,B错误;
C.能和溴发生加成反应的有碳碳双键,苯环上酚羟基邻位氢原子能被溴取代,所以1mol 乙酰紫草素最多可与4molBr2反应,C错误;
D.含有酚羟基,能发生显色反应, D正确。
答案选AD。
点晴:该类试题的关键是明确有机物分子中含有的官能团,然后联系相应代表物质的结构和性质分析解答即可。本题侧重于考查酚、酯的性质,注意酯基水解生成的羧基能和NaOH反应,是答题的易错点。


科目:高中化学 来源: 题型:
【题目】NaClO2的漂白能力是漂白粉的4~5倍, NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
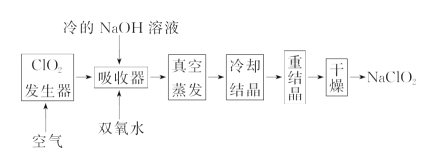
(1)ClO2气体发生器中的反应为:2NaClO3+SO2+H2SO4===2ClO2+2NaHSO4。实际工业生产中,可用硫黄、浓硫酸代替原料中的SO2,其原因为____________(用化学方程式表示)。
(2)反应结束后,向ClO2发生器中通入一定量空气的目的:________________________。
(3)吸收器中生成NaClO2的离子反应方程式为________________________________。
(4)CO和联氨(N2H4)的性质及应用的研究是能源开发、环境保护的重要课题。
①用CO、O2和KOH溶液可以制成碱性燃料电池,则该电池反应的离子方程式为_______________。
②用CO、O2和固体电解质还可以制成如下图所示的燃料电池,则电极d的电极反应式为__________。
(5)联氨的性质类似于氨气,将联氨通入CuO浊液中,有关物质的转化如图所示。
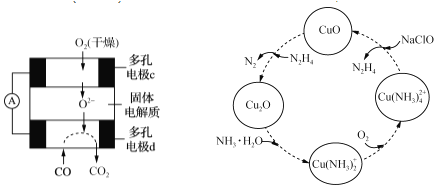
①在转化过程中通入氧气发生反应后,溶液的pH将________(填“增大”、“减小”或“不变”)。转化中当有1 mol N2H4参与反应时,需要消耗O2的物质的量为________。
②加入NaClO时发生的反应为:
Cu(NH3)42++2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
该反应需在80℃以上进行,其目的除了加快反应速率外,还有_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质间的每步转化通过一步反应能实现的是( )
A. Al-Al2O3-Al(OH)3-NaAlO2 B. Si-SiO2-H2SiO3-Na2SiO3
C. Cu-CuO-Cu(OH)2-CuSO4 D. Na-Na2O2-Na2CO3-NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A和2 mol B气体置于1 L的密闭容器中,混合后发生如下反应:2A(s) + B(g)=2C(g)。若经2 s后测得C的浓度为1.2 mol/L,下列说法正确的是( )
A. 用物质A表示的反应速率为0.6mol/(L·s)
B. 用物质B表示的反应速率为1.2mol/(L·s)
C. 2 s时物质A的转化率为30%
D. 2 s时物质B的浓度为0.6 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将一定物质的量的A、B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5 min后测得:A的转化率达到了最大值,且A和B的转化率相等,C的平均反应速率为0.2 mol/(L·min),D的浓度为0.5 mol/L。
xC(g)+2D(g),经5 min后测得:A的转化率达到了最大值,且A和B的转化率相等,C的平均反应速率为0.2 mol/(L·min),D的浓度为0.5 mol/L。
(1)判断:此反应此时_______(填“是”或“否”)达到了平衡状态。
(2)反应开始前容器中的A和B的物质的量之比为n(A):n(B)=_______。
(3)B的平均反应速率v(B)=________mol/(L·min)。
(4)x的值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0.6molFeBr2溶液中通入amolCl2。下列叙述不正确的是( )
A. 当a=0.2时,发生的反应为:2Fe2++Cl2=2Fe3++2Cl-
B. 当a=0.9时,发生的反应为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C. 若溶液中Br- 有一半被氧化时,c(Fe3+):c(Br-):c(Cl-)=l:1:3
D. 当0<a<0.3时,溶液中始终满足2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某学习小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
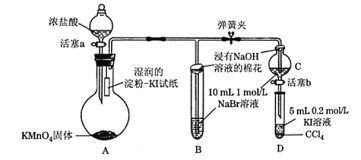
实验过程:
Ⅰ. 打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ. 当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ. 当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
回答问题:
(1)A中产生黄绿色气体,其电子式是_____。实验室在加热条件下制取该气体的离子方程式为_______。
(2)验证氯气的氧化性强于碘单质的实验现象是____________。
(3)C中溶液发生反应的离子方程式是_______________。
(4)过程Ⅲ实验的目的:甲同学认为试管B的作用就是吸收尾气,防止多余Cl2污染空气,因此B中盛装的最佳试剂应该为________。
乙同学经分析认为,B中溶液由黄色变为棕红色,发生反应的化学方程式为____________,以此说明C中_________,从而得出D中氧化I-的氧化剂必为Br2,因此B装置是必不可少的。
(5)过程Ⅳ为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下试管D震荡,静置,观察到的现象为___________,发生反应的离子方程式为_________。
(6)氯、溴、碘单质的氧化性逐渐减弱的本质原因:同主族元素从上到下_________,得电子能力逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。回答下列问题:
W | X | |||
Y | Z |
(1)X在元素周期表中的位置为____;画出X的简单离子结构示意图____。已知X元素的一种原子,其中子数为10,写出这种原子的原子符号_______。
(2)四种元素简单离子的半径由大到小为______(用离子符号表达)。
(3)W、X的最简单氢化物稳定性为____>____(填化学式)。
(4)Z最高价氧化物的水化物与Y最高价氧化物对应水化物反应的化学方程式为___ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个容积相同的容器中,一个盛有HCl气体,另—个盛有H2和Cl2的混合气体。在同温同压下, 两容器内的气体一定具有相同的( )
A. 原子数 B. 密度 C. 质量 D. 质子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com