
【题目】由CO2、H2、CO组成的混合气在同温同压下与氮气的密度相同,则该混合气中CO2、H2、CO的体积比是( )
A. 26:8:1 B. 22:1:14 C. 13:8:7 D. 26:6:17
【答案】C
【解析】
根据CO2、H2和CO碳组成的混合气体在同温、同压下与氮气的密度相同,可知混合气体的平均相对分子质量等于氮气的相对分子质量,即为28,而CO的相对分子质量也为28,则二氧化碳与氢气的平均相对分子质量必须为28,据此进行解答。
CO2、H2和CO组成的混合气体在同温、同压下与N2的密度相同,则混合气体的平均相对分子质量等于氮气的相对分子质量,即为28,由于CO的相对分子质量为28,则CO2和H2的平均相对分子质量为28即可,CO的体积不受限制,利用十字相乘法得二氧化碳和氢气的体积之比:![]() ,则CO2和H2的体积之比为26:16=13:8,CO的体积为任意体积,所以只有选项C符合条件,答案选C。
,则CO2和H2的体积之比为26:16=13:8,CO的体积为任意体积,所以只有选项C符合条件,答案选C。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】钨是熔点最高的金属,是重要的战略物资。自然界中钨主要存在于黑钨矿中,其主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、As的化合物。由黑钨矿冶炼钨的工艺流程如下:
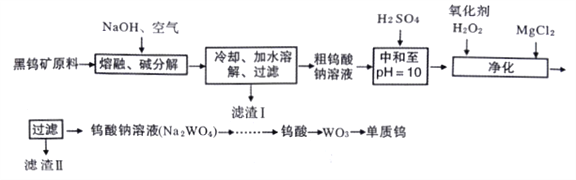
已知:
①滤渣I的主要成份是Fe2O3、MnO2。
②上述流程中,钨的化合价只有在最后一步发生改变。
③常温下钨酸难溶于水。
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为____,请写出MnWO4在熔融条件下发生碱分解反应生成Fe2O3的化学方程式__________。
(2)上述流程中向粗钨酸钠溶液中加硫酸中和至pH=10后,溶液中的杂质阴离子确SiO32-、HAsO32-、HAsO42-等,则“净化”过程中,加入H2O2时发生反应的离子方程式为____,滤渣Ⅱ的主要成分是____。
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。下图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则:
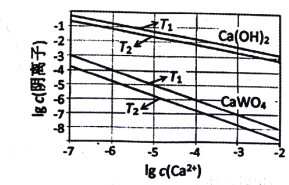
①T1 _____T2(填“>”或“<”)T1时Ksp(CaWO4)=____。
②将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关乙烯和乙烷的说法中错误的是![]()
![]()
A. 乙烯是平面分子,乙烷分子中所有原子不可能在同一平面内
B. 溴的四氯化碳溶液和酸性![]() 溶液都可以鉴别乙烯和乙烷
溶液都可以鉴别乙烯和乙烷
C. 溴的四氯化碳溶液和酸性![]() 溶液都可以除去乙烷中混有的乙烯
溶液都可以除去乙烷中混有的乙烯
D. 乙烯的化学性质比乙烷的化学性质活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氟化氮![]() 是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和
是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和![]() ,请根据要求回答下列问题:
,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素原子的物质的量之比为 ______ .
(2)写出该反应的化学方程式 ______ ![]() 若反应中生成
若反应中生成![]()
![]() ,转移的电子数目为 ______ 个
,转移的电子数目为 ______ 个![]()
(3)![]() 是一种无色、无臭的气体,但一旦
是一种无色、无臭的气体,但一旦![]() 在空气中泄漏,还是易于发现
在空气中泄漏,还是易于发现![]() 你判断该气体泄漏时的现象是 ______ .
你判断该气体泄漏时的现象是 ______ .
(4)一旦![]() 泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除
泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除![]() 、NaF、
、NaF、![]() 外,还肯定有 ______
外,还肯定有 ______ ![]() 填化学式
填化学式![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质间的每步转化通过一步反应能实现的是( )
A. Al-Al2O3-Al(OH)3-NaAlO2 B. Si-SiO2-H2SiO3-Na2SiO3
C. Cu-CuO-Cu(OH)2-CuSO4 D. Na-Na2O2-Na2CO3-NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置或操作进行相应实验,能达到实验目的的是

A. 用图1所示装置收集SO2气体
B. 用图2所示装置检验溴乙烷与NaOH醇溶液共热产生的乙烯
C. 用图3所示装置从食盐水中提取NaCl
D. 用图4所示装置制取并收集O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A和2 mol B气体置于1 L的密闭容器中,混合后发生如下反应:2A(s) + B(g)=2C(g)。若经2 s后测得C的浓度为1.2 mol/L,下列说法正确的是( )
A. 用物质A表示的反应速率为0.6mol/(L·s)
B. 用物质B表示的反应速率为1.2mol/(L·s)
C. 2 s时物质A的转化率为30%
D. 2 s时物质B的浓度为0.6 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0.6molFeBr2溶液中通入amolCl2。下列叙述不正确的是( )
A. 当a=0.2时,发生的反应为:2Fe2++Cl2=2Fe3++2Cl-
B. 当a=0.9时,发生的反应为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C. 若溶液中Br- 有一半被氧化时,c(Fe3+):c(Br-):c(Cl-)=l:1:3
D. 当0<a<0.3时,溶液中始终满足2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.二甲醚(DME)水蒸气重整制氢是一种有效解决氢源的方案,其包含的化学反应有:

(1)已知某些化学键的键能数据如下表所示:

请据此书写二甲醚(DME)水蒸气重整制氢的总反应的热化学方程式:_____。
(2)对于反应①,一定温度下,在一个 2L 的恒压密闭容器中充人 0.1 mol CH3OCH3(g)和 0.2 mol H2O(g)发生该反应,经过 10 min 反应达到平衡,此时CH3OCH3 ( g)与 CH30H(g)的分压之比为 3:4,则用 CH3OH(g)表示的平均反应速率为_________用分压计算表示该反应的平衡常数 Kp= ______保留两位小数)。(提示:某气体分压=总压×![]()
(3)将中间产物 CH3OH 氧化可制得 HCOOH。常温下,已知 HCOOH 的电离常数 Ka=1.8×10,,则物质的量浓度相同的 HCOOH 与 HCOONa 的混合溶液中,各粒子浓度 (不含 H2O)由大到小的顺序是_____。
(4)已知反应:HCOOH(过量)+K2C2O4 =KHC2O4+HCOOK; KHC2O4+CH3COOK =K2C2O4+CH3COOH。H2C204 的一、二级电 离常数分别记为 K1、K2,HCOOH、 CH3COOH 的电离常数分别记为 K3、K4,则 K1、K2、K3、K4 从大到小的排列顺序为____。
Ⅱ.图是一种正在投入生产的大型蓄电系统。左右两侧为电解质储罐,中央为电池,电解质通过泵不断 在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜;放电前,被膜隔开的电解质为 Na2S2 和 NaBr3,放电后,分别变为 Na2S4 和NaBr。

(1)写出电池放电时,负极的电极反应式:_____。
(2)电池中离子选择性膜宜采用_____(填“阳”或“阴”)离子交换膜。
(3)已知可溶性硫化物在溶液中能与硫单质反应,生成可溶性的多硫化物 Na2Sx。若通过加入 FeCl3 与 Na2S, 溶液作用获得单质 S,其离子方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com