
【题目】下列有关化学用语表示正确的是 ( )
A. 35Cl和37Cl的原子结构示意图均为![]()
B. HC1O的电子式:![]()
C. CO2的比例模型: ![]()
D. 乙烯的结构式:CH2=CH2
【答案】A
【解析】A. 35Cl和37Cl的质子数相同,属于同位素;B.次氯酸的中心原子为O,不存在H-Cl键;C.比例模型表示原子的相对大小及原子连接顺序、空间结构,根据元素周期表和元素周期律,碳原子半径比氧原子半径大;D.根据结构式和结构简式的区别分析判断。
A. 35Cl和37Cl的质子数相同,核外电子数也相同,原子结构示意图均为![]() ,故A正确;B. HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为
,故A正确;B. HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为![]() ,故B错误;C.二氧化碳的分子式为CO2,由模型可知小球为碳原子,2个大球为氧原子,氧原子半径大,实际碳原子半径大于氧原子半径,故C错误;D.CH2=CH2为乙烯的结构简式,不是结构式,故D错误;故选A。
,故B错误;C.二氧化碳的分子式为CO2,由模型可知小球为碳原子,2个大球为氧原子,氧原子半径大,实际碳原子半径大于氧原子半径,故C错误;D.CH2=CH2为乙烯的结构简式,不是结构式,故D错误;故选A。


科目:高中化学 来源: 题型:
【题目】三氟化氮![]() 是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和
是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和![]() ,请根据要求回答下列问题:
,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素原子的物质的量之比为 ______ .
(2)写出该反应的化学方程式 ______ ![]() 若反应中生成
若反应中生成![]()
![]() ,转移的电子数目为 ______ 个
,转移的电子数目为 ______ 个![]()
(3)![]() 是一种无色、无臭的气体,但一旦
是一种无色、无臭的气体,但一旦![]() 在空气中泄漏,还是易于发现
在空气中泄漏,还是易于发现![]() 你判断该气体泄漏时的现象是 ______ .
你判断该气体泄漏时的现象是 ______ .
(4)一旦![]() 泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除
泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除![]() 、NaF、
、NaF、![]() 外,还肯定有 ______
外,还肯定有 ______ ![]() 填化学式
填化学式![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0.6molFeBr2溶液中通入amolCl2。下列叙述不正确的是( )
A. 当a=0.2时,发生的反应为:2Fe2++Cl2=2Fe3++2Cl-
B. 当a=0.9时,发生的反应为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C. 若溶液中Br- 有一半被氧化时,c(Fe3+):c(Br-):c(Cl-)=l:1:3
D. 当0<a<0.3时,溶液中始终满足2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是( )
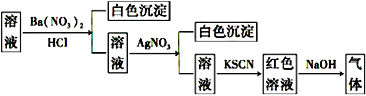
A. 原溶液中一定含有SO42-B. 原溶液中一定含有NH4+
C. 原溶液中一定含有Cl-D. 原溶液中一定含有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。回答下列问题:
W | X | |||
Y | Z |
(1)X在元素周期表中的位置为____;画出X的简单离子结构示意图____。已知X元素的一种原子,其中子数为10,写出这种原子的原子符号_______。
(2)四种元素简单离子的半径由大到小为______(用离子符号表达)。
(3)W、X的最简单氢化物稳定性为____>____(填化学式)。
(4)Z最高价氧化物的水化物与Y最高价氧化物对应水化物反应的化学方程式为___ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.二甲醚(DME)水蒸气重整制氢是一种有效解决氢源的方案,其包含的化学反应有:

(1)已知某些化学键的键能数据如下表所示:

请据此书写二甲醚(DME)水蒸气重整制氢的总反应的热化学方程式:_____。
(2)对于反应①,一定温度下,在一个 2L 的恒压密闭容器中充人 0.1 mol CH3OCH3(g)和 0.2 mol H2O(g)发生该反应,经过 10 min 反应达到平衡,此时CH3OCH3 ( g)与 CH30H(g)的分压之比为 3:4,则用 CH3OH(g)表示的平均反应速率为_________用分压计算表示该反应的平衡常数 Kp= ______保留两位小数)。(提示:某气体分压=总压×![]()
(3)将中间产物 CH3OH 氧化可制得 HCOOH。常温下,已知 HCOOH 的电离常数 Ka=1.8×10,,则物质的量浓度相同的 HCOOH 与 HCOONa 的混合溶液中,各粒子浓度 (不含 H2O)由大到小的顺序是_____。
(4)已知反应:HCOOH(过量)+K2C2O4 =KHC2O4+HCOOK; KHC2O4+CH3COOK =K2C2O4+CH3COOH。H2C204 的一、二级电 离常数分别记为 K1、K2,HCOOH、 CH3COOH 的电离常数分别记为 K3、K4,则 K1、K2、K3、K4 从大到小的排列顺序为____。
Ⅱ.图是一种正在投入生产的大型蓄电系统。左右两侧为电解质储罐,中央为电池,电解质通过泵不断 在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜;放电前,被膜隔开的电解质为 Na2S2 和 NaBr3,放电后,分别变为 Na2S4 和NaBr。

(1)写出电池放电时,负极的电极反应式:_____。
(2)电池中离子选择性膜宜采用_____(填“阳”或“阴”)离子交换膜。
(3)已知可溶性硫化物在溶液中能与硫单质反应,生成可溶性的多硫化物 Na2Sx。若通过加入 FeCl3 与 Na2S, 溶液作用获得单质 S,其离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,气体被还原的是
A. 乙烯使Br2的四氯化碳溶液褪色 B. 氨气使AlCl3溶液产生白色沉淀
C. 氯气使KBr溶液变黄 D. 二氧化碳使Na2O2固体变白
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关焰色反应的说法正确的是
A. 焰色反应是金属单质表现的性质
B. 焰色反应是因为发生了化学变化而产生的
C. 焰色反应看到黄色火焰并不能确定该物质一定不含钾元素
D. 洗涤焰色反应中用到的铂丝可用稀硫酸代替稀盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com