
【题目】I.某研究性学习小组根据反应: 2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O。设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。

回答下列问题:
(1)此原电池的正极是石墨________(填“a”或“b”),发生________反应。
(2)电池工作时,盐桥中的SO42-移向________(填“甲”或“乙”)烧杯。
(3)两烧杯中的电极反应式分别为
甲_____________________;
乙____________________。
(4)若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为________mol。
Ⅱ.次磷酸钴(II)[Co(H2PO2)2]广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如图。
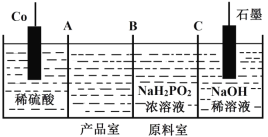
(5)A、B、C均为离子交换膜,其中为阳离子交换膜的是____________。
(6)阳极的电极反应式为________________。
(7)电解一段时间后,阴极室溶液的pH______(填“增大”“减小”或“不变”)。
(8)用Co(H2PO2)2溶液化学镀钴是在强碱性条件下通过发生自身氧化还原反应,反应的同时会生成HPO32-,其离子方程式为__________。
【答案】a 还原 乙 MnO4-+5e-+8H+=Mn2++4H2O 5Fe2+-5e-=5Fe3+ 0.5 A C Co-2e-=Co2+ 增大 Co2++ H2 PO2-+3OH- =Co+ HPO32-+ 2H2O
【解析】
I. (1)根据题目提供的总反应方程式可知,KMnO4作氧化剂,发生还原反应;
(2)电池工作时,SO42-向负极移动;
(3)甲烧杯中的电极反应式为MnO4-+5e-+8H+=Mn2++4H2O;乙烧杯中的电极反应式为5Fe2+-5e-=5Fe3+;
(4)溶液中的MnSO4浓度由1 mol·L-1变为1.5 mol ·L-1,由于溶液的体积未变,则反应过程中生成的MnSO4的物质的量为0.5 mol·L-1×0.2 L=0.1 mol,根据得失电子守恒计算;
Ⅱ.(5)以金属钴和次磷酸钠为原料,采用四室3个离子透过膜电渗析槽电解法制备次磷酸钴[Co(H2PO2)2],由图可知,负极上Co失去电子生成Co2+,通过膜A进入产品室,Na+通过膜C进入阴极室;
(6)Co为阳极,失去电子发生氧化反应,电极反应式为Co-2e-=Co2+;
(7)阴极室NaOH溶液中H2O(或H+)得到电子生成H2,电极反应式为2H2O+2e-=2OH-+H2↑(或2H++2e-=H2↑,促进水的电离生成NaOH);
(8)强碱性条件下,Co(H2PO2)2自身发生氧化还原反应生成Co和HPO32-,据此写反应d离子方程式。
I. (1)根据题目提供的总反应方程式可知,KMnO4作氧化剂,发生还原反应,故石墨a是正极,故答案为:a;还原;
(2)电池工作时,SO42-向负极移动,即向乙烧杯移动,故答案为:乙;
(3)甲烧杯中的电极反应式为MnO4-+5e-+8H+=Mn2++4H2O;乙烧杯中的电极反应式为5Fe2+-5e-=5Fe3+,故答案为:MnO4-+5e-+8H+=Mn2++4H2O;5Fe2+-5e-=5Fe3+;
(4)溶液中的MnSO4浓度由1 mol·L-1变为1.5 mol ·L-1,由于溶液的体积未变,则反应过程中生成的MnSO4的物质的量为0.5 mol·L-1×0.2 L=0.1 mol,转移的电子为0.1 mol×5=0.5 mol,故答案为:0.5;
Ⅱ.(5)以金属钴和次磷酸钠为原料,采用四室3个离子透过膜电渗析槽电解法制备次磷酸钴[Co(H2PO2)2],由图可知,负极上Co失去电子生成Co2+,通过膜A进入产品室,Na+通过膜C进入阴极室,故答案为:AC;
(6)Co为阳极,失去电子发生氧化反应,电极反应式为Co-2e-=Co2+,故答案为:Co-2e-=Co2+;
(7)阴极室NaOH溶液中H2O(或H+)得到电子生成H2,电极反应式为2H2O+2e-=2OH-+H2↑(或2H++2e-=H2↑,促进水的电离生成NaOH),使溶液中c(OH-)增大,pH增大,故答案为:增大;
(8)强碱性条件下,Co(H2PO2)2自身发生氧化还原反应生成Co和HPO32-,反应d离子方程式为Co2++ H2 PO2-+3OH- =Co+ HPO32-+ 2H2O,故答案为:Co2++ H2 PO2-+3OH- =Co+ HPO32-+ 2H2O。


科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)![]() xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
A. 反应速率v(B)=0.25 mol·L-1·min-1
B. 该反应方程式中x=1
C. 2min时,A的物质的量为1.5mol
D. 2min时,A的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
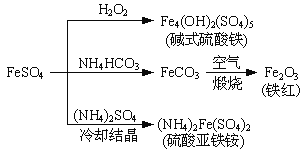
A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气态反应A(g)+3B(g)=2C(g)+2D(g),在四种不同条件下的反应速率如下,其中反应速率最快的是( )
A.vA=0.15mol/(L·min)B.vB=0.6mol/(L·min)
C.vC=0.4mol/(L·min)D.vD=0.6mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
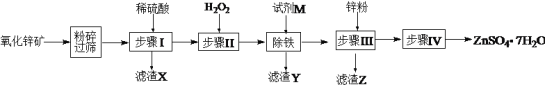
【题目】七水硫酸锌别名皓矾,常用作媒染剂、收敛剂、木材防腐剂。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4·7H2O的流程如下:
在该流程中,相关离子生成氢氧化物的pH如表:
开始沉淀时pH | 完全沉淀时pH | |
Zn2+ | 5.4 | 6.4 |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Cu2+ | 5.6 | 6.4 |
请回答下列问题:
(1)粉碎氧化锌矿石的目的是______________;滤渣X的成分是________________。
(2)步骤Ⅱ中加入H2O2目的是:_______________,发生反应的离子方程式为:______________。
(3)“除铁”步骤中加入试剂M调节溶液的pH,试剂M可以是________(填化学式,一种即可),控制溶液的pH范围为:_________。同时还需要将溶液加热,其目的是:__________。
(4)滤渣Z的成分是____________。
(5)取28.70 g ZnSO4·7H2O(相对分子质量:287)加热至不同温度,剩余固体的质量变化如图所示:
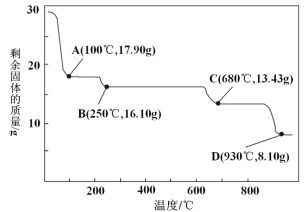
①步骤Ⅳ中的烘干操作需在减压条件下进行,其原因是____________。
②680 ℃时所得固体的化学式为________________。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钕铁硼磁铁是目前为止具有最强磁力的永久磁铁。生产钕铁硼磁铁的主要原材料有稀土金属钕、纯铁、铝、硼以及其他稀土原料。
(1)写出三价铁离子的外围电子排布图:___,在短周期元素中,与Al的化学性质最相似的元素符号是:___。
(2)实验测得AlCl3的蒸气以二聚分子Al2Cl6的形式存在,已知Al2Cl6分子中Al与Cl交替排列,为非极性分子,Al与Cl均满足8电子稳定结构,则Al2Cl6分子中Al原子采取___杂化,Al2Cl6分子的结构式为:___。
(3)硼(B)元素及与其同周期相邻的两种元素第一电离能由小到大的顺序为:___(用元素符号表示)。
(4)已知AlCl3的熔点为194℃,易升华,AlF3的熔点为1040℃,其原因为:___。
(5)已知立方氮化硼(BN)其晶胞结构类似于金刚石(如图所示),则N的配位数是___,与N原子距离最近的B原子构成的立体构型是___。

若图中b号原子的坐标为(![]() ,
,![]() ,0)写出a原子的坐标___,设晶胞中B、N原子半径分别为pnm、qnm,晶胞边长为rnm,则以a原子为中心形成的最小立方体的空间利用率为___(写代数式即可,不必化简);设晶胞中最近的B、N原子之间的距离为a nm,晶体的密度为bg·cm-3,则阿伏加德罗常数为___mol-1(用含a、b的代数式表示)。
,0)写出a原子的坐标___,设晶胞中B、N原子半径分别为pnm、qnm,晶胞边长为rnm,则以a原子为中心形成的最小立方体的空间利用率为___(写代数式即可,不必化简);设晶胞中最近的B、N原子之间的距离为a nm,晶体的密度为bg·cm-3,则阿伏加德罗常数为___mol-1(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.C4H10的一氯代物有2种
B.正戊烷分子中所有的碳原子均在同一条直线上
C.可用溴水来除去甲烷中混有的少量乙烯
D.某烃的分子式为C3H6,符合通式CnH2n,故该分子一定属于烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种二元弱酸。常温下,向H2C2O4溶液中逐滴加入NaOH溶液,混合溶液中lgX[X为![]() 或
或 ]与pH的变化关系如图所示。下列说法一定正确的是
]与pH的变化关系如图所示。下列说法一定正确的是
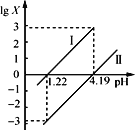
A.Ⅰ表示lg![]() 与pH的变化关系
与pH的变化关系
B.pH=1.22的溶液中:2c(C2O42-)+c(HC2O4-)=c(Na+)
C.根据图中数据计算可知,Ka2(H2C2O4)的数量级为10-4
D.pH 由1.22到4.19的过程中,水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。

(1)写出A中反应的化学方程式_______________。
(2)观察到A中的现象是_____________________。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________,写出有关的化学方程式______________________________。
(4)C中盛放CCl4的作用是________________。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入_______,现象是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com