
【题目】下列有关化学用语使用正确的是( )
A.CO2分子比例模型:![]()
B.硫离子的离子结构示意图:![]()
C.NH3的电子式:![]()
D.8个中子的碳原子的核素符号:12C
科目:高中化学 来源: 题型:
【题目】银精矿主要含有 Ag2S(杂质是铜、锌、锡和铅的硫化物),工业上利用银精矿制取贵金属银,流程图如下图所示。已知“ 氯化焙烧” 能把硫化物转化为氯化物,请回答下列问题:

(1)“ 氯化焙烧” 的温度控制在 650~670℃,如果温度过高则对焙烧不利,产率会降低,原因是 ______。
(2)水洗后的滤液中溶质有盐酸盐和大量钠盐,取少量滤液加入盐酸酸化,再滴入氯化钡溶液有白色沉淀生成,此钠盐为_____(填化学式)。
(3)氨浸时发生的化学反应方程式为________。
(4)“ 沉银” 是用 N2H4还原银的化合物。
①N2H4的电子式是_______。
②理论上,1molN2H4完全反应所得到的固体质量是______g。
③向所得母液中加入烧碱,得到的两种物质可分别返回________ 、______工序中循环使用。
(5)助熔剂 Na2CO3和 Na2B4O7有两个作用:一是降低了银的熔点,减少能耗;二是____。利用________的方法可以进一步直接精炼银锭。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自来水加工处理流程如图,下列有关说法不正确的是( )

A.若用FeSO4作混凝剂,最终铁将以Fe(OH)2形式进入反应沉淀池
B.投药时常加入适量的石灰,是为了除去水中Mg2+、HCO3﹣等
C.自来水生产中,前面加氯起消毒杀菌作用,后面加氯是保持水中有效氯的含量,防止自来水二次污染
D.用ClO2消毒自来水,消毒效率是等质量氯气的2.63倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
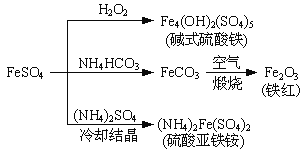
A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 W、X、Y、Z 的原子序数依次递增,a、b、c、d、e、f 是由这些元素组成的化合物,d 是淡黄色粉末,m 为元素 Y 的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法错误的是

A.简单离子半径:Z<Y
B.简单气态氢化物的热稳定性:Y<X
C.阴离子的还原性:Y>W
D.W2Y2 中含有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气态反应A(g)+3B(g)=2C(g)+2D(g),在四种不同条件下的反应速率如下,其中反应速率最快的是( )
A.vA=0.15mol/(L·min)B.vB=0.6mol/(L·min)
C.vC=0.4mol/(L·min)D.vD=0.6mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
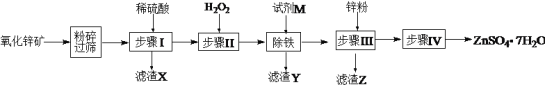
【题目】七水硫酸锌别名皓矾,常用作媒染剂、收敛剂、木材防腐剂。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4·7H2O的流程如下:
在该流程中,相关离子生成氢氧化物的pH如表:
开始沉淀时pH | 完全沉淀时pH | |
Zn2+ | 5.4 | 6.4 |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Cu2+ | 5.6 | 6.4 |
请回答下列问题:
(1)粉碎氧化锌矿石的目的是______________;滤渣X的成分是________________。
(2)步骤Ⅱ中加入H2O2目的是:_______________,发生反应的离子方程式为:______________。
(3)“除铁”步骤中加入试剂M调节溶液的pH,试剂M可以是________(填化学式,一种即可),控制溶液的pH范围为:_________。同时还需要将溶液加热,其目的是:__________。
(4)滤渣Z的成分是____________。
(5)取28.70 g ZnSO4·7H2O(相对分子质量:287)加热至不同温度,剩余固体的质量变化如图所示:
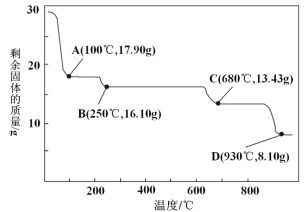
①步骤Ⅳ中的烘干操作需在减压条件下进行,其原因是____________。
②680 ℃时所得固体的化学式为________________。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.C4H10的一氯代物有2种
B.正戊烷分子中所有的碳原子均在同一条直线上
C.可用溴水来除去甲烷中混有的少量乙烯
D.某烃的分子式为C3H6,符合通式CnH2n,故该分子一定属于烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用图1装置(夹持仪器已省略)制备溴苯,并探究该反应原理。
Ⅰ.制备溴苯
(1)装置中长导管a的作用是__________、导出气体。
(2)本实验所获得的溴苯为褐色,是因为_________.
Ⅱ.分离提纯
已知,溴苯与苯互溶,液溴、苯、溴苯的沸点依次为59℃、80℃、156℃。同学们设计了如图2流程:
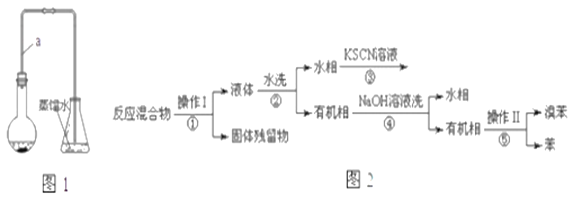
(3)操作Ⅱ为________.
(4)流程②和④中,需要用到的玻璃仪器是烧杯、___;流程③的现象为____,流程④的作用是_____.
Ⅲ.探究原理
(5)反应结束后,某同学取少量锥形瓶中的液体于试管中,再滴入几滴AgNO3溶液,出现浅黄色浑浊,从而判断反应一定生成了HBr,你认为该同学的判断________(填“合理”、“不合理”)。
(6)为探究锥形瓶中溶液的离子,请完成如表探究实验方案(限选试剂:镁粉、四氯化碳、氯水、溴水、蒸馏水)
实验步骤 | 预期现象 | 结论 |
1.将锥形瓶中的液体转入分液漏斗,加足量①__,振荡后分液。分别取少量②_层溶液于试管A、B中 | _______ | ______ |
2.向试管A中加入少量③___和四氯化碳,振荡后静置; | 溶液分层,下层显④___色 | 锥形瓶中液体含大量Br |
3.向试管B中加入⑤___. | 有汽泡生成 | 锥形瓶中液体含大量⑥___ |
根据上述结论推断,制备溴苯的反应属于___反应,其反应方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com