
【题目】下列各项中指定的比值是2∶1的是 ( )
A. C2H4在氧气中充分燃烧生成的CO2与H2O的物质的量之比
B. K2S溶液中c(K+)与c(S2-)之比
C. Na2O2晶体中阳离子与阴离子的物质的量之比
D. CsCl晶体中阴、阳离子的配位数比
【答案】C
【解析】
A、根据完全燃烧方程式进行判断;
B、硫离子在溶液中发生水解;
C、过氧化钠由钠离子与过氧根离子构成;
D、CsCl是由离子构成的晶体,阳离子与阴离子配位数之比为1:1。
A、C2H4在氧气中充分燃烧的方程式为:C2H4+3O2![]() 2CO2+2H2O,生成的CO2与H2O的物质的量之比为1:1,选项A不符合题意;
2CO2+2H2O,生成的CO2与H2O的物质的量之比为1:1,选项A不符合题意;
B、K2S溶液中S2-发生水解,c(K+)与c(S2-)之比大于2:1,选项B不符合题意;
C、过氧化钠由钠离子与过氧根离子构成,钠离子与过氧根离子数目之比为2:1,选项C符合题意;
D、CsCl是由离子构成的晶体,阳离子与阴离子配位数之比为1:1,选项D不符合题意;
答案选C。


科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A.16.2g淀粉在催化剂作用下完全水解得到产物的分子数为0.1NA
B.28g乙烯与26g苯中所含的碳碳双键数均为NA
C.1molNa与足量乙醇完全反应,断裂H-O键数目为2NA
D.在密闭容器中,1molO2与2molSO2在适当催化剂作用下充分反应得到生成物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是

A. 催化剂a表面发生了极性共价键的断裂和形成
B. N2与H2反应生成NH3的原子利用率为100%
C. 在催化剂b表面形成氮氧键时,不涉及电子转移
D. 催化剂a、b能提高反应的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只用如图所示装置进行下列实验,能够得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si | |
B | 饱和食盐水 | 电石 | 高锰酸钾溶液 | 生成乙炔 | |
C | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
D | 浓硫酸 | Na2SO3 | 溴水 | SO2具有还原性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生命的物质基础是组成细胞的元素和化合物,图中序号代表不同的化合物,面积不同代表含量不同,其中Ⅰ和Ⅱ代表两大类化合物。请据图分析下列叙述正确的是( )
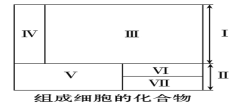
A. 若Ⅴ和Ⅵ分别代表蛋白质和脂质,则Ⅶ代表核酸
B. 上述物质中氧原子含量最高的化合物是Ⅱ
C. 医用生理盐水和糖溶液中的溶质分别属于Ⅳ和Ⅴ
D. 细胞干重和鲜重中含量最多的分别是Ⅴ和Ⅲ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A、B、C、D是同周期或同主族的相邻元素:
D | ||
A | B | C |
(1)已知:A元素的最低价为-3价,它的最高价氧化物含氧56.34%,原子核内中子数比质子数多1个,则A元素原子的质量数为_____。
(2)写出元素符号:A_____,C_____,D____。
(3)A、B、C三种元素最高价氧化物的水化物中酸性最强的是____(填化学式)。
(4)B、D两种元素和氢组成的气态氢化物中稳定性最强的是___,还原性最强的____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料尼龙66具有良好的抗冲击性、韧性、耐燃油性和阻燃、绝缘等特点,因此广泛应用于汽车、电气等工业中。以下是生产尼龙66的一些途径。
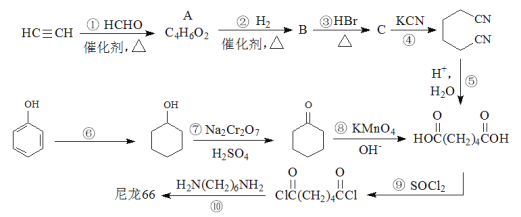
(1)A的结构简式为_____________。
(2)B中官能团的名称是_____________。
(3)反应①~④中,属于加成反应的有_______,反应⑥~⑨中,属于氧化反应的有_______。
(4)请写出反应⑥的化学方程式_____________。
(5)高分子材料尼龙66中含有![]() 结构片段,请写出反应⑩的化学方程式_____________。
结构片段,请写出反应⑩的化学方程式_____________。
(6)某聚合物K的单体与A互为同分异构体,该单体核磁共振氢谱有三个峰,峰面积之比为1:2:3,且能与NaHCO3溶液反应,则聚合物K的结构简式是_____________。
(7)聚乳酸(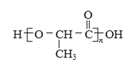 )是一种生物可降解材料,已知羰基化合物可发生下述
)是一种生物可降解材料,已知羰基化合物可发生下述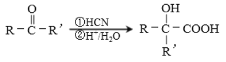 反应: (R′可以是烃基或H原子)。用合成路线图表示用乙醇制备聚乳酸的过程。_______________
反应: (R′可以是烃基或H原子)。用合成路线图表示用乙醇制备聚乳酸的过程。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯橄岩为含镁的硅酸盐矿物,并含有MnO、Fe2O3、FeO、SiO2和一些有机物等杂质。工业上利用纯橄岩制备一水硫酸镁(MgSO4·H2O)的工艺流程如下:
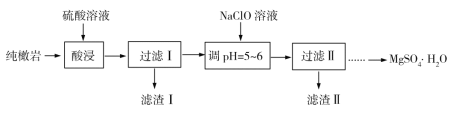
(1)浸出时温度控制在90℃~100℃之间,并且要连续搅拌2小时的目的是___________。
(2)上述流程中多次用到了过滤操作,实验室过滤时需要用到的玻璃仪器是玻璃棒、烧杯和________________。
(3)向过滤Ⅰ的滤液中加入NaClO溶液,将溶液中的Mn2+氧化成MnO2,反应的离子方程式为________________________________。
(4)滤渣Ⅱ中主要成分为________________(填化学式)。
(5)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验操作方法是________________________。
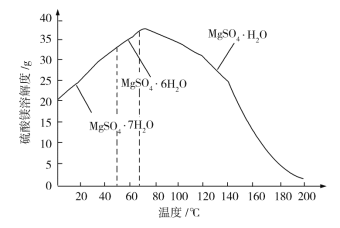
(6)已知硫酸镁的溶解度随温度变化的曲线如下图,且溶液的沸点随压强增大而升高。为了从滤液中充分回收MgSO4·H2O,采取将滤液蒸发浓缩、加压升温结晶的方法,采取加压升温结晶的原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定条件下,CO2与1.0mol·L-1NaOH溶液充分反应放出的热量如下表:
反应序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量/kJ |
1 | 0.5 | 0.75 | X |
2 | 1.0 | 2.00 | y |
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学方程式为_____________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒温容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒温容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表:
温度 t/min | 0 | 40 | 80 | 120 | 160 |
甲(673K) | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(T) | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
丙(673K) | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
②该反应的△H__________(填序号)
a.大于0 b.小于0 c.等于0 d.不能确定
③丙容器达到平衡时,NO的转化率为__________________。
(3)298K时,NH3·H2O的电离常数Kb=2×10-5,H2CO3的电离常数Kal=4×10-7,Ka2=4×10-11。在NH4HCO3溶液中,c(NH4+)__________c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K的数值(用科学计数法表示)为_____。
NH3·H2O+H2CO3的平衡常数K的数值(用科学计数法表示)为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com