
【题目】纯橄岩为含镁的硅酸盐矿物,并含有MnO、Fe2O3、FeO、SiO2和一些有机物等杂质。工业上利用纯橄岩制备一水硫酸镁(MgSO4·H2O)的工艺流程如下:
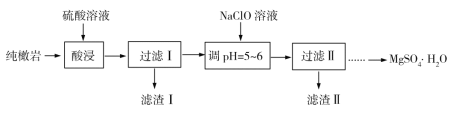
(1)浸出时温度控制在90℃~100℃之间,并且要连续搅拌2小时的目的是___________。
(2)上述流程中多次用到了过滤操作,实验室过滤时需要用到的玻璃仪器是玻璃棒、烧杯和________________。
(3)向过滤Ⅰ的滤液中加入NaClO溶液,将溶液中的Mn2+氧化成MnO2,反应的离子方程式为________________________________。
(4)滤渣Ⅱ中主要成分为________________(填化学式)。
(5)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验操作方法是________________________。
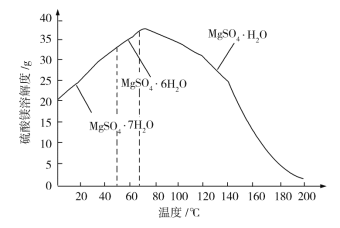
(6)已知硫酸镁的溶解度随温度变化的曲线如下图,且溶液的沸点随压强增大而升高。为了从滤液中充分回收MgSO4·H2O,采取将滤液蒸发浓缩、加压升温结晶的方法,采取加压升温结晶的原因是________________________________。
【答案】提高纯橄岩中镁的浸出率 漏斗 Mn2++ClO+H2O![]() MnO2↓+2H++Cl Fe(OH)3、MnO2 取过滤Ⅱ后的滤液1~2 mL于试管中,加入少量KSCN溶液,如果溶液不显红色,证明滤液中无Fe3+ 增大压强,溶液沸点升高,溶液能够达到较高温度,有利于MgSO4·H2O晶体析出
MnO2↓+2H++Cl Fe(OH)3、MnO2 取过滤Ⅱ后的滤液1~2 mL于试管中,加入少量KSCN溶液,如果溶液不显红色,证明滤液中无Fe3+ 增大压强,溶液沸点升高,溶液能够达到较高温度,有利于MgSO4·H2O晶体析出
【解析】
分析流程过程,纯橄岩用硫酸进行酸浸,硅酸盐与硫酸反应生成硫酸盐和硅酸沉淀,MnO、Fe2O3、FeO与硫酸反应生成相应的硫酸盐和水,SiO2不与硫酸反应也不溶于硫酸,以滤渣形式除去,故滤渣Ⅰ的成分可确定。滤液中加入NaClO溶液,可将Fe2+氧化为Fe3+,将Mn2+氧化为MnO2,通过调节pH=5~6,将Fe3+转化为Fe(OH)3沉淀除去。则可知滤渣Ⅱ的成分。据此进行分析。
(1)浸出时升高温度、连续搅拌,其目的是提高纯橄岩中镁的浸出率;答案为:提高纯橄岩中镁的浸出率;
(2)过滤时用到的玻璃仪器是玻璃棒、烧杯和漏斗;答案为:漏斗;
(3)NaClO将溶液中的Mn2+氧化成MnO2,本身被还原为Cl,依据守恒即可写出反应的离子方程式:Mn2++ClO+H2O![]() MnO2↓+2H++Cl;答案为:Mn2++ClO+H2O
MnO2↓+2H++Cl;答案为:Mn2++ClO+H2O![]() MnO2↓+2H++Cl;
MnO2↓+2H++Cl;
(4)加入NaClO溶液,能将Fe2+氧化为Fe3+,将溶液中的Mn2+氧化成MnO2,调节溶液pH=5~6,将Fe3+转化为Fe(OH)3沉淀,滤渣Ⅱ中主要成分为Fe(OH)3、MnO2;答案为:Fe(OH)3、MnO2;
(5)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是用KSCN溶液,具体操作为取过滤Ⅱ后的滤液1~2 mL于试管中,加入少量KSCN溶液,如果溶液不显红色,证明滤液中无Fe3+;答案为:取过滤Ⅱ后的滤液1~2 mL于试管中,加入少量KSCN溶液,如果溶液不显红色,证明滤液中无Fe3+;
(6)从图中可以看出,升高温度,有利于MgSO4·H2O晶体析出,增大压强,溶液的沸点升高,溶液能够达到较高温度,有利于MgSO4·H2O晶体析出。答案为:增大压强,溶液沸点升高,溶液能够达到较高温度,有利于MgSO4·H2O晶体析出。


科目:高中化学 来源: 题型:
【题目】某化学课外小组用图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。

(1)写出A中反应的化学方程式_______________。
(2)观察到A中的现象是_____________________。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________,写出有关的化学方程式______________________________。
(4)C中盛放CCl4的作用是________________。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入_______,现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中指定的比值是2∶1的是 ( )
A. C2H4在氧气中充分燃烧生成的CO2与H2O的物质的量之比
B. K2S溶液中c(K+)与c(S2-)之比
C. Na2O2晶体中阳离子与阴离子的物质的量之比
D. CsCl晶体中阴、阳离子的配位数比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚乙酯是锂离子电池低温电解液的重要添加剂,其结构如下图。下列有关该物质的说法不正确的是
![]()
A. 分子式为C3H4O3B. 分子中σ键与π键个数之比为3:1
C. 分子中既有极性键也有非极性键D. 分子中碳原子的杂化方式全部为sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的物质的量分数(分布系数)δ随溶液pH变化的关系如图所示,下列说法正确的是
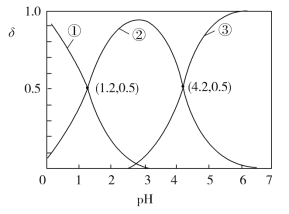
A.曲线①代表的粒子是HC2O4-
B.H2C2O4的Ka1=-1.2
C.向草酸溶液中滴加KOH溶液至pH=4.2:c(K+)<3c(C2O42-)
D.浓度均为0.01 mol·L1的草酸与KOH溶液等体积混合并充分反应得到的溶液:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将1molN2O4充入容积固定为2 L的密闭容器中,发生反应:N2O4![]() 2NO2(g)。经2s达到化学平衡状态,此时测得容器中c(NO2)=0.2mol/L。
2NO2(g)。经2s达到化学平衡状态,此时测得容器中c(NO2)=0.2mol/L。
(1)下列说法中,一定能说明该反应达到平衡状态的是_________(填序号)。
A.正、逆反应均已停止 B. v(NO2)=2v(N2O4)
C.容器中 c(NO2) : c(N2O4)=2∶1 D.混合气体的密度不变
E.混合气体的压强不变 F.混合气体的颜色不变
(2)0~2 s内反应的平均速率v(NO2)=___________________。
(3)达到平衡时容器中c(N2O4)=______________________。
(4)达到平衡时,N2O4转化率为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下氨气能被氯气氧化生成N2,化工厂常用此法检验管道是否泄漏氯气。某探究小组在实验室对氨气与氯气反应进行了探究,回答下列问题。
Ⅰ.氨气的制备
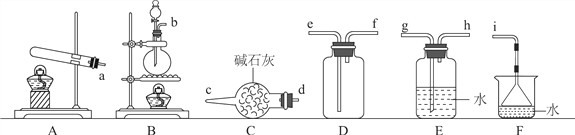
(1)氨气的发生装置可以选择上图中的________(填大写字母),反应的化学方程式为____________________________________。
(2)欲收集一瓶干燥的氨气,选择上图中的装置,按气流方向写出其接口的连接顺序:发生装置管口→________(填小写字母)。
Ⅱ.氯气与氨气的反应
室温下,用收集到的氨气按下图所示装置进行实验(实验前k1、k2关闭)。
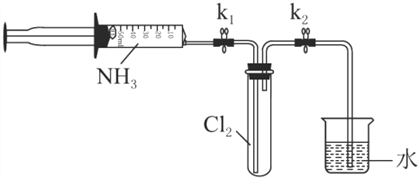
(3)打开k1,缓缓推动注射器活塞,向试管中注入约3倍于氯气体积的氨气,关闭k1,恢复室温。试管中可观察到的现象是________。发生反应的化学方程式为________。
(4)再打开k2,可观察到的现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜矿石的主要成分是Cu2O,还含有少量的Al2O3、Fe2O3和SiO2。某学习小组模拟化工生产设计了如下流程制备精铜。

已知:Cu2O + 2 H+ = Cu + Cu2+ + H2 O
回答下列问题:
(1)实际生产中,常将铜矿石粉碎的目的是______________________________。
(2)滤渣1中含有较多的铜,提纯滤渣1时反应的离子方程式为_______________________________。
(3)滤液1中铁元素的存在形式为______________(填离子符号),检验该离子的常用试剂为________________。
(4)写出加入铝粉时生成铜的化学方程式:______________________________。
(5)“电解”精炼过程中,粗铜与外接电源的___________极相连;阴极的电极反应式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质的结构简式:
(1)2,4,6-三甲基-5-乙基辛烷:________________________________;
(2)3-甲基-1-戊炔:______________________________;
(3)1,4-戊二烯:______________________________;
(4)苯乙烯:___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com