
【题目】化学与生产和生活等联系紧密。下列说法正确的是( )
A.“白色污染”泛指聚乙烯、聚丙烯等塑料污染,它们的分子内部都含有双键
B.聚丙烯酸酯类涂料(![]() )是目前流行的墙面涂料之一,它是通过缩聚反应形成的
)是目前流行的墙面涂料之一,它是通过缩聚反应形成的
C.制作手术缝合线或人造器官材料可以是聚乳酸或聚氨酯等
D.制作航天服的聚酯纤维和用于光缆通信的光导纤维都属于新型有机高分子材料
科目:高中化学 来源: 题型:
【题目】下列关于分子组成为CxHy的烷烃、烯烃、炔烃的说法中不正确的是( )
A.当x≤4时,常温常压下均为气体
B.y一定为偶数
C.燃烧1mol CxHy时,消耗氧气(x+![]() )mol
)mol
D.在密团容器中完全燃烧,150℃时测得的压强一定比燃烧前的增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的位置如图所示,其中 W 元素的原子序数为Z元素原子序数的两倍,下列说法正确的是
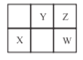
A.X在元素周期表中位于第3周期第VIA 族
B.X、Y、Z三种元素对应原子的半径依次减小
C.XZ2 和YZ2 的化学性质相似
D.利用 W 的含氧酸酸性强于Y 的含氧酸酸性,可证明非金属性:W>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应![]() ,
,![]() 为金属
为金属![]() ,下列推断中不正确的是
,下列推断中不正确的是![]()
![]()
A.BrCl同![]() 、
、![]() 具有相似的化学性质
具有相似的化学性质
B.常温下,BrCl可与NaOH反应生成NaCl和NaBrO
C.BrCl跟水的反应是氧化还原反应
D.BrCl的氧化性强于![]() ,弱于
,弱于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,混合气体对氢气的相对密度为13,在标准状况下,将56.0L混合气体通入足量溴水,溴水质量增重35.0g,则这两种烃分别是( )
A. CH4 C5H12 B. C2H6 C4H8 C. CH4 C4H8 D. C2H2 C4H10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰![]() ,硫氰
,硫氰![]() 等称为拟卤素,与卤素单质性质相似,它们的阴离子与也卤素阴离子性质相似,阴离子的还原性顺序为:
等称为拟卤素,与卤素单质性质相似,它们的阴离子与也卤素阴离子性质相似,阴离子的还原性顺序为:![]() ,又知,拟卤素形成的无氧酸和含氧酸一般为弱酸,下列反应中,不合理的是( )
,又知,拟卤素形成的无氧酸和含氧酸一般为弱酸,下列反应中,不合理的是( )
A.![]() 浓
浓![]()
![]()
![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂和防腐剂、乙酰苯胺的制备原理为![]() +CH3COOH
+CH3COOH +H2O
+H2O
实验参数
名称 | 相对分 子质量 | 性状 | 密度(g/mL) | 沸点(℃) | 溶解性 | |
苯胺 | 93 | 无色油状液体 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚 |
乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
乙酰 苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,可溶于热水 | 易溶于乙醇、乙醚 |
实验装置如图所示(部分仪器及夹持装置已略去)。
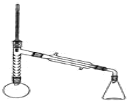
注:①刺型分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。②苯胺易被氧化。
实验步骤:
步骤1:在100mL圆底烧瓶中加入无水苯胺9.3mL、冰醋酸18.4mL、锌粉0.1g和少量沸石,安装好仪器后,对圆底烧瓶均匀加热,使反应液在微沸状态下回流,调节加热温度,使温度计温度控制在105℃左右;反应约60~80min,反应生成的水及少量醋酸被蒸出,当反应基本完成时,停止加热。
步骤2:在搅拌下,趁热将蒸馏烧瓶中的液体以细流状倒入盛有冰水的100mL烧杯中,快速搅拌,乙酰苯胺结晶析出,烧杯内试剂冷却至室温后,进行抽滤、洗涤、干燥,可得到乙酰苯胺粗品。
步骤3:将乙酰苯胺粗品进行重结晶,待结晶完全后抽滤,尽量压甘干滤饼。将产品置于干净的表面皿中晾干,称重,计算产率;
请回答下列问题:
(1)实验中加入锌粉的目的是_____________________。
(2)从化学平衡的角度分析,控制温度计的温度在105℃左右的原因是______________。
(3)步骤1加热可用_____________(填“水浴”或“油浴”)。
(4)洗涤乙酰苯胺粗品最合适的方法是__________________(填字母)。
A.用少量冷水洗B.用少量热水洗
C.先用冷水洗,再用热水洗D.用酒精洗
(5)步骤2得到的粗品中因含有某些杂质而颜色较深,步骤3重结晶的操作是:将粗品用热水溶解,加入活性炭0.1g,煮沸进行脱色,______________,再将滤液冷却结晶。
(6)该实验最终得到产品9.1g,则乙酰苯胺的产率是____________(小数点后保留两位数字。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.铝片与稀盐酸的反应B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与CO2的反应D.甲烷在氧气中的燃烧反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com