
【题目】下列关于分子组成为CxHy的烷烃、烯烃、炔烃的说法中不正确的是( )
A.当x≤4时,常温常压下均为气体
B.y一定为偶数
C.燃烧1mol CxHy时,消耗氧气(x+![]() )mol
)mol
D.在密团容器中完全燃烧,150℃时测得的压强一定比燃烧前的增加
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】碘化钠在医疗及食品方面有重要的作用。实验室用NaOH、单质碘和水合肼(N2H·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH![]() N2H4·H2O+NaCl+Na2CO3
N2H4·H2O+NaCl+Na2CO3
①制取次氯酸钠和氧氧化钠混合液的连接顺序为__________(按气流方向,用小写字母表示)。
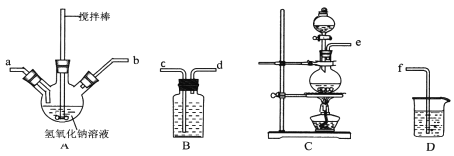
若该实验温度控制不当,反应后测得三颈瓶内ClO-与ClO3-的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为________。
②制备水合肼时,应将___________滴到 __________ 中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:
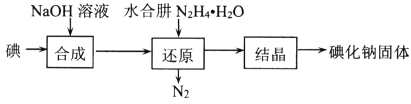
在“还原”过程中,主要消耗反应过程中生成的副产物IO3-,该过程的离子方程式为______________________________________。工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是_________________________________。
(3)测定产品中NaI含量的实验步骤如下:
a.称取10.00g样品并溶解,在500mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂:
c.用0.2100mol·L-1的Na2S2O3标准溶液滴定至终点(反应方程式为;2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00mL。
①M为____________(写名称)。
②该样品中NaI的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。

已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.2 |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
请回答下列问题:
(1)写出Na2SiO3的一种用途________________________。
(2)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
①最好选用盐酸和________两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式_______________________________________________。
(3)为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH=b发生反应的离子方程式为___________________________________________;
检验Fe3+是否沉淀完全的操作方法是_________________________________________。
(4)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L恒容密闭容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t1 min 时达到平衡。
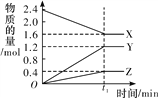
(1)请写出该反应的化学方程式:_____________________________。
(2)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为________;在此t1 min时间内,用H2表示该反应的平均速率v(H2)为__________。下列叙述能判断该反应达到平衡状态的是________(填字母代号)。
A.容器内各气体组分的质量分数不再发生改变
B.正反应速率与逆反应速率相等
C.容器内气体的密度不再发生改变
D.混合气体的平均相对分子质量不再发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种电化学制备NH3的装置如图所示,图中陶瓷在高温时可以传输H+。请回答下列问题:
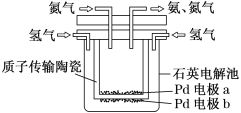
(1)此装置将______能转化为______能。
(2)Pd电极a为_____极(选填“正”、“负”、“阴”或“阳”),电极反应式为___。
(3)当制得6mol氨气时有____mol 质子从____极迁移到____极 (选填“a”或“b”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】湿法炼锌产生的铜镉渣主要含锌、镉(Cd)、铜、铁、钴(Co)等金属单质。利用铜镉渣可生产Cu、Cd及ZnSO4·7H2O 等,其生产流程如图:
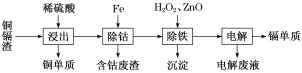
如表是部分金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1 mol·L-1计算):
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Zn(OH)2 |
开始沉淀的pH | 1.9 | 7.0 | 7.2 | 5.4 |
沉淀完全的pH | 3.2 | 9.0 | 9.5 | 8.2 |
请回答下列问题:
(1)提高铜镉渣的“浸出”速率的措施有________________________________(写出1条即可)。
(2)Fe的金属性比Co强,该流程中“除钴”________(填“能”或“不能”)用Zn代替Fe,“除钴”中Fe发生反应的离子方程式是__________________________________。
(3)“除铁”操作中加入H2O2的目的是______________________________,加入ZnO的目的是调节溶液pH,以除去溶液中的铁元素,调节溶液pH的范围为_________,“除铁”操作中的沉淀成分是__________(写化学式)。
(4)“电解”操作中,Cd2+在________极放电得到金属Cd,电极反应式是________________________。
(5)“电解”后的电解废液是ZnSO4溶液,用该电解废液制备ZnSO4·7H2O的方法是__________________。
(6)“除钴”后的含钴废渣在空气中煅烧,煅烧后的成分测定如表:
元素 | Co | Zn | Cu | Fe |
含量/% | 59.00 | 0.52 | 0.20 | 13.16 |
则煅烧后所得固体混合物中,钴氧化物的化学式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些牙膏中含有茶多酚,茶多酚是茶叶中多酚类物质的总称,是目前尚不能人工合成的纯天然、 多功能、高效能的抗氧化剂和自由基净化剂。其中没食子儿茶素(GC)的结构简式如图所示,下列关于GC的叙述中正确的是( )
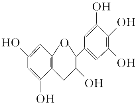
A.分子中所有的原子共面
B.1 mol GC与6 mol NaOH恰好完全反应
C.能发生氧化反应、取代反应、消去反应,难发生加成反应
D.遇FeCl3溶液不发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业在国民经济中占有极其重要的地位。
(1)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有________(任写一种)。
(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有________(填写序号)。
A.矿石加入沸腾炉之前先粉碎
B.使用V2O5作催化剂
C.转化器中使用适宜的温度
D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行
F.吸收塔中用98.3%的浓硫酸吸收SO3
(3)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:2SO2(g)+![]() O2(g)
O2(g)![]() 2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。
2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。
(4)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔)。
①三个设备分别使反应物之间或冷热气体之间进行“对流”。请简单描述吸收塔中反应物之间是怎样对流的。______________________________。
②工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理。(只写出2个方程式即可)________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产和生活等联系紧密。下列说法正确的是( )
A.“白色污染”泛指聚乙烯、聚丙烯等塑料污染,它们的分子内部都含有双键
B.聚丙烯酸酯类涂料(![]() )是目前流行的墙面涂料之一,它是通过缩聚反应形成的
)是目前流行的墙面涂料之一,它是通过缩聚反应形成的
C.制作手术缝合线或人造器官材料可以是聚乳酸或聚氨酯等
D.制作航天服的聚酯纤维和用于光缆通信的光导纤维都属于新型有机高分子材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com