
【题目】W、X、Y、Z四种短周期元素在元素周期表中的位置如图所示,其中 W 元素的原子序数为Z元素原子序数的两倍,下列说法正确的是
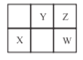
A.X在元素周期表中位于第3周期第VIA 族
B.X、Y、Z三种元素对应原子的半径依次减小
C.XZ2 和YZ2 的化学性质相似
D.利用 W 的含氧酸酸性强于Y 的含氧酸酸性,可证明非金属性:W>Y
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中有可逆反应:![]() ;
;![]() 处于平衡状态
处于平衡状态![]() 已知
已知![]() ,则下列说法正确的是
,则下列说法正确的是![]()
①升温时![]() 的值减小②降压时体系内混合气体的平均相对分子质量减小③加入B,A的转化率变大④加入催化剂,气体的总物质的量不变⑤充入C,则A、B的物质的量增大
的值减小②降压时体系内混合气体的平均相对分子质量减小③加入B,A的转化率变大④加入催化剂,气体的总物质的量不变⑤充入C,则A、B的物质的量增大
A.③④B.①②⑤C.②③⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰是重要的微量元素肥料之一,易溶于水,难溶于乙醇。工业上用软锰矿(主要成分是MnO2,含有少量Fe2O3、Al2O3、MgO、SiO2)通过如下简化流程既可脱除燃煤尾气中的SO2,又能制备硫酸锰晶体,实现了资源的综合利用:
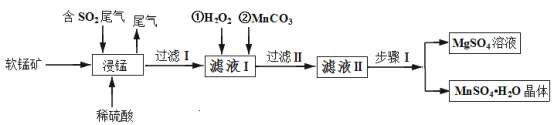
请回答下列问题:
(1)上述流程中第一步浸锰脱硫的好处是_________(答出一点即可)。
(2)写出浸锰过程中软锰矿中的MnO2发生的化学方程式_________。
(3)通过实验如何判定滤液Ⅰ中已加入足量H2O2 __________;加MnCO3的目的是调节溶液的pH,使滤液Ⅰ中的相关离子形成沉淀而除去,请写出 “过滤 Ⅱ”中所得滤渣的主要成分有________。
(4)已知硫酸锰晶体和硫酸镁晶体的溶解度曲线如图所示。
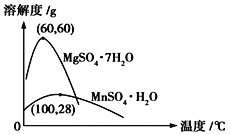
请写出步骤Ⅰ操作_________、趁热过滤;为了保证产品的纯度,同时又减少产品的损失,应选择下列溶液中的________(填选项字母)进行洗涤,实验效果最佳。
A 乙醇 B 饱和K2SO4溶液 C 蒸馏水 D 乙醇水溶液
(5)滤液Ⅱ还可通过加入过量NH4HCO3进行“50℃碳化”得到高纯碳酸锰,反应的离子方程式为_________。“50℃碳化”可能的原因是:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含NaOH 20.0g的稀溶液与足量稀盐酸反应,放出28.7 kJ的热量,表示该反应的热化学方程式正确的是( )
A.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H= +28.7 kJ·mol-1
B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H= _28.7 kJ·mol-1
C.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H=+57.4 kJ·mol-1
D.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H= _57.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下反应N2(g)+3H2(g)2NH3(g)达到化学平衡状态的标志是( )
A.c(N2) :c(H2):c(NH3)=1 :3 :2
B.当![]() 不随时间而变化
不随时间而变化
C.N2与H2的物质的量之和是NH3物质的量的2倍
D.单位时间里每增加1molN2,同时减少2mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两池电极材料都是铁棒与碳棒(如图),乙池箭头方向为电子移动方向。请回答:

(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的_________棒;乙池中的________棒。
②在乙池中阳极的电极反应是__________。
(2)若两池中均盛放滴加少量酚酞的饱和NaCl溶液。
①甲池中的铁容易发生腐蚀,该腐蚀属于电化学腐蚀中的_________腐蚀。
②测得乙池中有0.2mol电子发生转移,则标准状况下理论共有_________L气体生成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点。下图是某同学用0.1mol/L KOH 溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH 溶液滴定曲线示意图(混合溶液体积变化忽略不计)。下列有关判断不正确的是
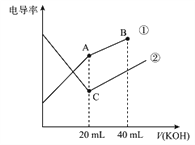
A. 曲线①代表0.1mol/L KOH 溶液滴定CH3COOH溶液的滴定曲线,曲线②代0.1mol/LKOH 溶液滴定HCl溶液的滴定曲线
B. 在相同温度下,C点水电离的c (H+) 大于A点水电离的c(H+)
C. 在A 点的溶液中有: c(CH3COO-)+c(OH-)-c (H+)=0.05mol/L
D. 在B 点的溶液中有: c(K+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法不正确的是
A.等体积、等物质的量浓度的NaCl(aq) 离子总数大于NaClO(aq)中离子总数
B.pH=3的硫酸溶液中水的电离程度等于pH=11的氨水溶液中水的电离程度
C.0.1 mol/L的NaHA溶液pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A)
D.向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的种类相当多,如大象式、回路式、能级式、亚历山大式等,教材上所附的长式周期表是目前使用最普遍的周期表。有一种非常有趣的钟表式周期表如图所示,下列说法正确的是( )

A.12:00时“时针”所指元素的金属性最强
B.从中午12:00点到晚上23:00点,“时针”所指元素的金属性依次减弱
C.9:55时“时针”和“分针”所指的两种元素(“针”所指以最近为准)形成的化合物中阴、阳离子之比为1:1
D.2:00时,“时针”和“分针”所指的元素的原子最外层均只有两个电子,性质相似
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com