
����Ŀ��Ԫ�����ڱ��������൱�࣬�����ʽ����·ʽ���ܼ�ʽ������ɽ��ʽ�ȣ��̲��������ij�ʽ���ڱ���Ŀǰʹ�����ձ�����ڱ�����һ�ַdz���Ȥ���ӱ�ʽ���ڱ���ͼ��ʾ������˵����ȷ���ǣ� ��

A.12��00ʱ��ʱ������ָԪ�صĽ�������ǿ
B.������12��00�㵽����23��00�㣬��ʱ������ָԪ�صĽ��������μ���
C.9��55ʱ��ʱ����������������ָ������Ԫ�أ���������ָ�����Ϊ���γɵĻ�����������������֮��Ϊ1��1
D.2��00ʱ����ʱ����������������ָ��Ԫ�ص�ԭ��������ֻ���������ӣ���������
���𰸡�C
��������
A. 12��00ʱ��ʱ������ָԪ��Ϊþ��þ�Ľ����Ա�������A����
B. ������12��00�㵽����23��00�㣬��ʱ������ָԪ�صĽ���������Ϊþ��ﮡ��롢�ƣ��������ݱ���ɣ�B����
C. 9��55ʱ��ʱ����������������ָ������Ԫ�طֱ�ΪF��Na�������γɵĻ�����ΪNa F������������֮��Ϊ1��1��C��ȷ��
D. 2��00ʱ����ʱ����������������ָ��Ԫ��Ϊ����þ��ԭ��������ֻ���������ӣ������ʲ�ͬ��D����
��ѡC��


 ����ͬ�����Ծ�ϵ�д�
����ͬ�����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z���ֶ�����Ԫ����Ԫ�����ڱ��е�λ����ͼ��ʾ������ W Ԫ�ص�ԭ������ΪZԪ��ԭ������������������˵����ȷ����
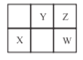
A.X��Ԫ�����ڱ���λ�ڵ�3���ڵ�VIA ��
B.X��Y��Z����Ԫ�ض�Ӧԭ�ӵİ뾶���μ�С
C.XZ2 ��YZ2 �Ļ�ѧ��������
D.���� W �ĺ���������ǿ��Y �ĺ��������ԣ���֤���ǽ����ԣ�W>Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��Ч�������������ػ�����ȡ��ʩ���ƴ������������У����ƿ����е����������������ĺ�����Ϊ��Ҫ��
(1)úȼ�ղ����������к��е���������,��CH4����ԭNO2�����������������Ⱦ����֪��
��CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ��H= -867.0kJ/mol��
��N2(g)+2O2(g)=2NO2(g) ��H=+67.8kJ/mol��
��N2(g)+O2(g)=2NO(g) ��H=+89.0kJ/mol
��CH4����ԭNO���Ȼ�ѧ����ʽΪ_______��
(2)��0.20mol NO��0.10mol CO����һ���¶Ⱥ㶨���ݻ���Ϊ2L���ܱ������з�����Ӧ2NO(g)+2CO(g)=N2(g)+2CO2(g)����ʵ�ֵ��������ת������Ӧ�����в������ʵ����ʵ����仯��ͼ��ʾ��
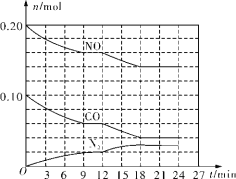
��N2��0��9min�ڵ�ƽ����Ӧ����v(N2)��________mol/(L��min)(������λ��Ч����)��
����12minʱ�ı�ķ�Ӧ��������Ϊ________(����ĸ����)��
a������ˮ����ϡ�ͷ�Ӧ�� b������NO c���Ӵ��� d������ѹǿ
(3)�����£������е�SO2����ijŨ�ȵ�NaOH��Һ���յõ�pH=7����Һ���Լ���������Һ��![]() ��_____(��֪:������H2SO3�ĵ���ƽ�ⳣ��Ka1=1.0��10-2��Ka2=6.0��10-8)��
��_____(��֪:������H2SO3�ĵ���ƽ�ⳣ��Ka1=1.0��10-2��Ka2=6.0��10-8)��
(4)�����е�SO2Ҳ����Na2SO3��Һ���գ����չ����У�pH��n(SO32-):n(HSO3-)�仯��ϵ���±���
n(SO32-):n(HSO3-) | 99��1 | 1��1 | 1��99 |
pH | 8.2 | 7.2 | 6.2 |
������Һ������ʱ����Һ������Ũ�ȹ�ϵ��ȷ����(ѡ����ĸ): ___________
a��c(Na��)=2c(SO32-)��c(HSO3-)
b��c(Na��)>c(HSO3-)>c(SO32-)>c(H��)=c(OH-)
c��c(Na��)+c(H+) =c(SO32-)+c(HSO3-)+c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� A��B��C��D��E��F��G ����Ԫ�أ������������������ƶϣ�
��A��B��C ��ͬһ���ڵĽ���Ԫ�أ���֪ԭ�Ӻ�����3�����Ӳ㣬A ��ԭ�Ӱ뾶�����������������ԭ�Ӱ뾶��A>B>C��
��D��E �Ƿǽ���Ԫ�أ��������⻯�Ͽ�������̬�⻯�� HD �� HE�������£�D �ĵ�����Һ�壬E �ĵ����ǹ��壻
��F�ǵؿ��к�������Ԫ�أ�G �Ƿǽ�������ǿ��Ԫ��
(1)C ���ӵĽṹʾ��ͼΪ________________________ ��E ���ʵ���ɫΪ_________��
(2)�õ���ʽ��ʾB��D Ԫ���γɵĻ�������γɹ��̣�_____________________________ ��
(3)�� G��F Ԫ�زμӵ��û���Ӧ�Ļ�ѧ����ʽΪ___________________________ ��
(4)�����ӷ���ʽ֤��D��E Ԫ�صķǽ�����ǿ�������õ����ű�ʾ����ת�Ƶķ������Ŀ��________________________��
(5)�ô̿� C����(����)����ס2.3gA ���ʷ���ˮ�У���״���£��ռ��������������Ϊ_____L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���ּ����������£�
��ѧ�� | Si��Cl | H��H | H��Cl | Si��Si |
����/kJ��mol��1 | 360 | 436 | 431 | 176 |
��ҵ�ϸߴ����ͨ�����з�Ӧ��ȡ��SiCl4(g)��2H2(g)![]() Si(s)��4HCl(g)���÷�Ӧ�ķ�Ӧ�Ȧ�HΪ�� ��
Si(s)��4HCl(g)���÷�Ӧ�ķ�Ӧ�Ȧ�HΪ�� ��
A.��412 kJ��mol��1B.��236 kJ��mol��1C.��412 kJ��mol��1D.��236 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ϩ����ˮ������(GMA)��Ҫ���ڸ߷��ӽ��ҡ����ӽ�����֬��ӡˢ��ī��ճ�ϼ�����ϳ�·�����£�

��ش��������⣺
(1)GMA�еĹ�����������_________________________________��
(2)���͵Ľṹ��ʽ��___________��F�Ľṹ��ʽ___________��
(3)��д��B��C��D��E�Ļ�ѧ����ʽ�����жϷ�Ӧ���ͣ�
B��C��_________________________________��___________��Ӧ��
D��E��_________________________________��___________��Ӧ��
(4)E�ĺ˴Ź����������֮���ɴ�СΪ___________��E��ͬ���칹�����ܷ���ˮ�ⷴӦ����״��������___________�֡�
(5)��֪CH2=CH2����Ag����������������O2��Ӧ����![]() ���ݴ������һ���ɱ�ϩ����F��·�ߡ�____________________________________________��
���ݴ������һ���ɱ�ϩ����F��·�ߡ�____________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20.00mL0.1mol/L��MOH��Һ��μ���һ��Ũ�ȵ�HA��Һ�μӹ�����,��Һ��pH�����HA��Һ�������ϵ��ͼ��ʾ����pH=8ʱMOH��Һǡ�ñ��к͡�������˵���������
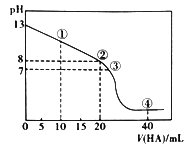
A. �ڵ�����Һ��ˮ�������c(H+)����HA��Һ����ˮ�������c(H+)
B. �۵�����Һ�и�����Ũ�ȵĴ�С��ϵ��c(M+)=c(A-)>c(H+)=c(OH-)
C. ��HA��Һ��Ũ��Ϊ0.1mol/L
D. ������Һ��������c(HA)+c(H+)>c(M+)+c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ж��������뾶�Ĵ�С
(1)Mg__________Ba��
(2)K__________Ca��
(3)��̬ԭ��X��Χ�����Ų�Ϊ3s23p5________________��̬ԭ��Y�۵����Ų�3s23p4��
(4)S2��__________S��
(5)N3��__________Na����
(6)��̬ԭ��![]() __________��̬ԭ��Z
__________��̬ԭ��Z![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д����������Һˮ������ӷ��̡�
��1��(NH4)2SO4��______________________________________________��
��2��FeCl3��_________________________________________________��
��3��Na2CO3��_________________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com