
【题目】已知部分键能数据如下:
化学键 | Si—Cl | H—H | H—Cl | Si—Si |
键能/kJ·mol-1 | 360 | 436 | 431 | 176 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热ΔH为( )
Si(s)+4HCl(g),该反应的反应热ΔH为( )
A.+412 kJ·mol-1B.+236 kJ·mol-1C.-412 kJ·mol-1D.-236 kJ·mol-1
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】一定温度下反应N2(g)+3H2(g)2NH3(g)达到化学平衡状态的标志是( )
A.c(N2) :c(H2):c(NH3)=1 :3 :2
B.当![]() 不随时间而变化
不随时间而变化
C.N2与H2的物质的量之和是NH3物质的量的2倍
D.单位时间里每增加1molN2,同时减少2mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/L的NaOH溶液滴定某浓度的二元弱酸(![]() )溶液,所得溶液中各种含X的微粒的物质的量分数(
)溶液,所得溶液中各种含X的微粒的物质的量分数(![]() )与pH的变化曲线如图所示。下列说法正确的是
)与pH的变化曲线如图所示。下列说法正确的是

A. ![]() 的电离常数
的电离常数![]() ,
, ![]() 的水解常数
的水解常数![]()
B. 由水电离出的c(![]() ):a>b
):a>b
C. 曲线![]() 分别表示
分别表示![]() (
(![]() )和
)和![]() (HX-)的变化
(HX-)的变化
D. b点所示溶液中:c(![]() >3c(
>3c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 3.2g铜溶于过量的浓硝酸完全反应生成的气体的物质的量一定为0.1mol
B. 78gNa2S和Na2O2的混合物中阳离子与阴离子的个数比不能确定
C. 25℃HCN的电离平衡常数为5.0×10-10,则浓度均为0.10mol·L-1NaCN和HCN的混合溶液中有c(Na+)>c(CN-)>c(OH-) >c(H+)
D. Fe(NO3)2溶液中加入过量的HI溶液:Fe2++NO3-+4H++2I-=I2+Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有硫酸与硝酸的混合液,取出其中10 mL,加入足量的BaCl2溶液,将生成的沉淀过滤洗涤,干燥称得质量为9.32 g。另取这种溶液10 mL与4 mol·L-1的NaOH溶液25 mL恰好中和。计算:
(1)混合液中H2SO4的物质的量浓度是______
(2)混合液中HNO3的物质的量浓度是______
(3)另取10 mL的混合液与0.96 g铜粉共热时,产生气体在标准状况体积是______L?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的种类相当多,如大象式、回路式、能级式、亚历山大式等,教材上所附的长式周期表是目前使用最普遍的周期表。有一种非常有趣的钟表式周期表如图所示,下列说法正确的是( )

A.12:00时“时针”所指元素的金属性最强
B.从中午12:00点到晚上23:00点,“时针”所指元素的金属性依次减弱
C.9:55时“时针”和“分针”所指的两种元素(“针”所指以最近为准)形成的化合物中阴、阳离子之比为1:1
D.2:00时,“时针”和“分针”所指的元素的原子最外层均只有两个电子,性质相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制造太阳能电池需要高纯度的硅,工业上制高纯度的硅常用以下化学反应实现:
①Si(s)+3HCl(g)![]() SiHCl3(g)+H2(g)(放热反应);②SiHCl3(g)+H2(g)
SiHCl3(g)+H2(g)(放热反应);②SiHCl3(g)+H2(g)![]() Si(s)+3HCl(g)。
Si(s)+3HCl(g)。
以下对上述两个化学反应的叙述,其中错误的是( )
A.两个反应都是置换反应
B.反应②是放热反应
C.两个反应都有化学能与热能之间的转化
D.两个反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,几种弱酸的电离平衡常数如下表所示,下列说法正确的是
化学式 | HCOOH | H2CO3 | HCN |
电离平衡常数 | K=1.8×10-4 | K1=4.3×10-7 K2=5.6×10-11 | K=4.9×10-10 |
A. 酸性强弱顺序是HCOOH>HCN> H2CO3
B. HCOOH的电离平衡常数表达式为
C. Na2CO3溶液显碱性,NaHCO3溶液显酸性
D. H2CO3溶液和NaCN溶液反应的离子方程式为H2CO3+CN-=HCO3-+HCN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂。以废铁屑(含有少量Ni)为主要原料制备高铁酸钾的流程如下:
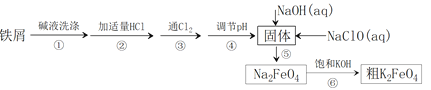
资料显示:一些金属氢氧化物开始沉淀和完全沉淀的pH如下:
M(OH)n | pH | |
开始沉淀 | 沉淀完全 | |
Fe(OH)3 | 2.53 | 2.94 |
Ni(OH)2 | 7.60 | 9.75 |
(1)高铁酸钾具有高效消毒主要是因其具有__________性所致。
(2)步骤③反应的离子方程式是_______。
(3)步骤④不能引入新杂质,调节pH所用的某种氧化物的化学式是___________,调节pH的范围是__________________。
(4)步骤⑤发生反应的离子方程式是________。
(5)该流程中可循环利用的物质是:_______(写化学式)。
(6)步骤⑥中,由Na2FeO4 得到粗K2FeO4的原理可能是___________。
(7)测定产品纯度:将wg粗产品,溶入过量的碱性亚铬酸盐溶液中,充分反应后,加入稀硫酸酸化至pH为2,在所得的重铬酸盐溶液中加入5滴二苯胺磺酸钠溶液作指示剂,然后用c mol·L1 (NH4)2Fe(SO4)2溶液滴定至终点,消耗滴定液V mL。有关滴定反应有:
Cr(OH)4-+FeO42-+3H2O![]() Fe(OH)3·3H2O↓+CrO42- +OH
Fe(OH)3·3H2O↓+CrO42- +OH
2![]() +2H
+2H![]()
![]() +H2O
+H2O
![]() +6Fe2++14H
+6Fe2++14H![]() 2Cr3++6Fe3++7H2O
2Cr3++6Fe3++7H2O
该粗产品中K2FeO4的纯度为____________(用含w、c、V的代数式表示)。若滴定管没有用待装液润洗,则测得结果________(“偏高”“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com