
����Ŀ��������أ�K2FeO4�����и�Ч���������ã�Ϊһ�����ͷ��ȸ�Ч���������Է���м����������Ni��Ϊ��Ҫԭ���Ʊ�������ص��������£�
������ʾ��һЩ�����������↑ʼ��������ȫ������pH���£�
M(OH)n | pH | |
��ʼ���� | ������ȫ | |
Fe(OH)3 | 2.53 | 2.94 |
Ni(OH)2 | 7.60 | 9.75 |
(1)������ؾ��и�Ч������Ҫ���������__________�����¡�
(2)����۷�Ӧ�����ӷ���ʽ��_______��
(3)����ܲ������������ʣ�����pH���õ�ij��������Ļ�ѧʽ��___________������pH�ķ�Χ��__________________��
(4)����ݷ�����Ӧ�����ӷ���ʽ��________��
(5)�������п�ѭ�����õ������ǣ�_______��д��ѧʽ����
(6)������У���Na2FeO4 �õ���K2FeO4��ԭ��������___________��
(7)�ⶨ��Ʒ���ȣ���wg�ֲ�Ʒ����������ļ����Ǹ�������Һ�У���ַ�Ӧ����ϡ�����ữ��pHΪ2�������õ��ظ�������Һ�м���5�ζ�������������Һ��ָʾ����Ȼ����c mol��L1 (NH4)2Fe(SO4)2��Һ�ζ����յ㣬���ĵζ�ҺV mL���йصζ���Ӧ�У�
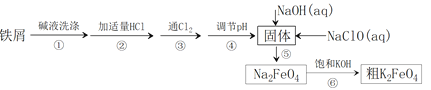
Cr(OH)4-��FeO42-��3H2O![]() Fe(OH)3��3H2O����CrO42- +OH
Fe(OH)3��3H2O����CrO42- +OH
2![]() ��2H
��2H![]()
![]() ��H2O
��H2O
![]() ��6Fe2+��14H
��6Fe2+��14H![]() 2Cr3+��6Fe3+��7H2O
2Cr3+��6Fe3+��7H2O
�ôֲ�Ʒ��K2FeO4�Ĵ���Ϊ____________���ú�w��c��V�Ĵ���ʽ��ʾ�������ζ���û���ô�װҺ��ϴ�����ý��________����ƫ������ƫ����������Ӱ��������
���𰸡�ǿ������ 2Fe2++Cl2�� 2Fe3++2Cl�� Fe2O3 2.94�QpH��7.60 2Fe(OH)3 + 3ClO��+4OH���� 2FeO42��+3Cl��+ 5H2O NaOH K2FeO4���ܽ�ȱ�Na2FeO4��С���ӱ���KOH����������Na2FeO4���� (33cv/5w)�� ƫ��
��������
�Ÿ�������������ϼ۴�����ۣ����и�Ч����������Ҫ���������ǿ���������£��ʴ�Ϊǿ�����ԣ�
�Ʋ�������Ӧ�����ӷ���ʽ��2Fe2++Cl2 = 2Fe3++2Cl�����ʴ�Ϊ2Fe2+ + Cl2 = 2Fe3+ +2Cl����
�Dz������������������ʣ���Ҫ���������ӵ���������������Һ�е������ӣ���˵���pH���õ�ij��������Ļ�ѧʽ��Fe2O3��ʹ���������ӷ�Ӧ�����ڣ�Ҫ��������ȫ��ˮ���꣬�������Ӳ���ˮ����������е���pH�ķ�Χ��2.94�� pH��7.60���ʴ�ΪFe2O3��2.94�� pH��7.60��
�Ȳ����������������ʹ������Ʒ���������ԭ��Ӧ����˷�����Ӧ�����ӷ���ʽ��2Fe(OH)3 + 3ClO��+4OH��= 2FeO42��+3Cl��+ 5H2O���ʴ�Ϊ2Fe(OH)3 + 3ClO��+4OH��= 2FeO42��+3Cl��+ 5H2O��
�ɸ������и������ƺ��������ط�Ӧ���ɸ�����غ��������ƣ���˿�ѭ�����õ��������������ƣ��ʴ�ΪNaOH��
�ʲ������У�����K2FeO4���ܽ��С��Na2FeO4 ���ܽ�ȣ��ӱ���KOH����������Na2FeO4���壬�ʴ�ΪK2FeO4���ܽ�ȱ�Na2FeO4��С���ӱ���KOH����������Na2FeO4���壻
�˸����������̷���
Cr(OH)4����FeO42����3H2O![]() Fe(OH)3��3H2O����CrO42�� +OH��
Fe(OH)3��3H2O����CrO42�� +OH��
2![]() ��2H
��2H![]()
![]() ��H2O
��H2O
![]() ��6Fe2+��14H
��6Fe2+��14H![]() 2Cr3+��6Fe3+��7H2O
2Cr3+��6Fe3+��7H2O
���ݷ�Ӧ�ó����¹�ϵ��
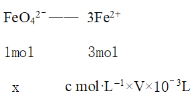
![]()
![]()
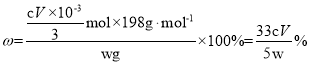
�ôֲ�Ʒ��K2FeO4�Ĵ���Ϊ![]() �����ζ���û���ô�װҺ��ϴ�����ĵ�(NH4)2Fe(SO4)2��Һ���ƫ�ߣ���ý��ƫ�ߣ��ʴ�Ϊ
�����ζ���û���ô�װҺ��ϴ�����ĵ�(NH4)2Fe(SO4)2��Һ���ƫ�ߣ���ý��ƫ�ߣ��ʴ�Ϊ![]() ��ƫ�ߡ�
��ƫ�ߡ�


 ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д� ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д� ����ϰ�⽭��ϵ�д�
����ϰ�⽭��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����͵��ĵ��ʼ�һЩ�������ڹ�ũҵ��������������ҪӦ�á��ش���������:
��1��Nԭ�Ӻ�����___ �ֲ�ͬ�˶�״̬�ĵ��ӡ���̬Nԭ���У�������ߵĵ�����ռ�ݵ�ԭ�ӹ������״Ϊ____________________________��
��2�����ⶨ���֣�N2O5������NO2+ ��NO3-����������ɣ��ù�����Nԭ���ӻ�����Ϊ_________����NO2+��Ϊ�ȵ����������_______(д��һ��)��
��3��HF��HI�����H+���ѵ���________���ѧʽ����ͬ������δ��ȶ�����Ԥ��NH4F��NH4I�У����ֽ����________��
��4���ڶ������У���һ�����ܽ���BԪ�غ�NԪ�ؼ��Ԫ��Ϊ_____(�Ԫ�ط��š�)��
��5���������ж��ֱ��壬��������ṹ��Ԫ��������ԭ����ɵ�����ʮ����( ��ͼI)��ÿ������Ϊһ����ԭ��,ÿ�������ξ�Ϊ�ȱ������Ρ���ÿһ���˻����ṹ��Ԫ��_______����ԭ�ӹ���;���ýṹ��Ԫ����2 ��ԭ��Ϊ10B(����Ϊ11B)����ô�ýṹ��Ԫ��_____�ֲ�ͬ���͡�
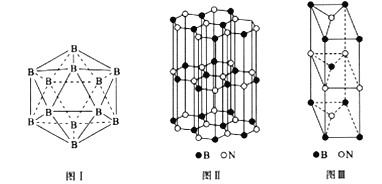
��6����͵����ɵ�һ�ֵ�������Ľṹ��ʯī����ṹ�����ƣ�B��Nԭ�����������(��ͼII)���侧���ṹ��ͼIII��ʾ���þ�����_____��B��_____��N��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ��һ��ʳ�����ϣ���ṹ��ʽ��ͼ��ʾ���й�����ϩ�ķ�����ȷ����
![]()
A.һ�������£����ֱ���Է����ӳɡ�ȡ������������ԭ�ȷ�Ӧ
B.���Ͷ�����(![]() )��Ϊͬ���칹��
)��Ϊͬ���칹��
C.���ķ��������е�̼ԭ��һ����ͬһƽ����
D.����һ�ȴ�����6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������A���������Բ������Է�������Ϊ84�������к���̼̼˫����������ֻ��һ�����͵��⡣
(1)�������µ�ʵ����������
A.1H�˴Ź����� B.������
C.��������� D.Ԫ�ط�����
����ѡ��ֱ���ʲô����
�ٲ����Է�������________������ĸ����ͬ����
�ڲ��������̼̼˫��________��
�۲���������͵���________��
(2)��������Ϣ�������ж�A�Ľṹ��ʽΪ________��
(3)����ͼ�У�D1��D2��Ϊͬ���칹�壬E1��E2��Ϊͬ���칹�塣
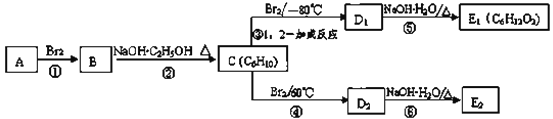
��Ӧ�ڵĻ�ѧ����ʽΪ_________��
C�Ļ�ѧ����Ϊ__________����Ӧ����Ϊ��__________��
E2�Ľṹ��ʽ��_________��
�ܡ��ݵķ�Ӧ����������________��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ǽ���Ԫ��A��B��C��D��E�����ڶ�����Ԫ�أ���ԭ��������������AԪ��ԭ���γɵ����Ӻ��������Ϊ�㣬Bԭ�ӵ��������������ڲ��������2����ͨ��״����E�ĵ����ǻ�ɫ���壬������ˮ�������ڶ���̼��D��E��ͬһ���壬C��D�����ڱ��д������ڵ�λ�ã���ش��������⣺
(1)AԪ�ص�������________��E�������ӽṹʾ��ͼ��__________________��
(2)Ԫ��C������������Ӧˮ����������̬�⻯�ﷴӦ���ɻ�����Z���÷�Ӧ�����ӷ���ʽΪ____________________________________________��������Z����________________(�������ӻ��������������ۻ�������)��Z�к��еĻ�ѧ��������________________��
(3)CԪ�ص�����������Ӧ��ˮ�����ϡ��Һ����D��EԪ���γɵ�һ�ֻ������������ԭ��Ӧ�������ӷ�Ӧ����ʽΪ__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A.��״���£�2.24L���Ȼ�̼�к��й��ۼ�����Ϊ0.4NA
B.46g NO2��N2O4�Ļ�������У����еĵ�ԭ����Ϊ1NA
C.1L1.0mol/L�������к���HCl������ΪNA
D.һ�������£���2molSO2��1molO2��ַ�Ӧ���õ�SO3�ķ�����Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���⣺
1-�������һ����Ҫ���л��ϳ��м��壬�е�Ϊ71�棬�ܶ�Ϊ1.36g��cm-3��ʵ�����Ʊ����� 1-��������Ҫ�������£�
���� 1�������� A �м��������ӡ�12g �������� 20mLˮ����ˮ��ȴ�»������� 28mlŨ H2SO4����ȴ�����£������¼��� 24gNaBr��
(��֪�� ��2NaBr+H2SO4(Ũ)![]() Na2SO4+2HBr��
Na2SO4+2HBr��
����������Ũ���Ṳ�Ȼ������ϩ���ѵȸ���Ʒ)
���� 2����ͼ��ʾ�ʵ��װ�ã��������ȣ�ֱ������״�����Ϊֹ��
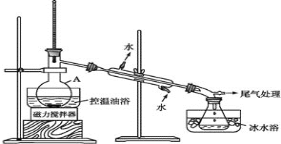
���� 3�������Һת���Һ©�����ֳ��л��ࡣ
���� 4�����ֳ����л���ת���Һ©���������� 12mLH2O��12ml5%Na2CO3 ��Һ��12mLH2O ϴ�ӣ���Һ���ôֲ�Ʒ����һ���ᴿ�� 1-����顣
(1)���� A ��������_____��
(2)��Ӧʱ���ɵ���Ҫ�л������� 2-������_______(���һ�ּ��ɸ���)
(3)���� 2 ���������ƿ�ڼ���������ˮ�����ڱ�ˮԡ�е�Ŀ����____��
(4)���� 1 ��Ũ H2SO4 ��ˮϡ�ͣ�����ȴ�����º��ټ� NaBr ��Ŀ����______������ 4 ���� Na2CO3 ��Һϴ�ӵ�Ŀ����_____��
(5)���� 4 �н�һ���ᴿ 1-�����ķ�����_________���ڽ��д˲���֮ǰ��Ҫ ����ˮMgBr2 �����ֲ�Ʒ����Ŀ����_____��
(6)1-�������һ��������Ҳ�����Ʊ� 1-����,��д���ɲ��� 1-������Ʊ� 1-�����Ļ�ѧ��Ӧ����ʽ________________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����塣�����ܱ������еķ�Ӧ��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��ʱ��仯�Ĺ�ϵ����ͼ��ʾ������������ȷ���ǣ� ��
��ʱ��仯�Ĺ�ϵ����ͼ��ʾ������������ȷ���ǣ� ��
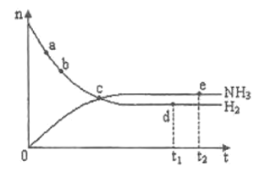
A.��a������Ӧ���ʱȵ�b�Ĵ�
B.��c����Ӧ�ﵽƽ��
C.��d��![]() ʱ�̣���
ʱ�̣���![]() ���ڵ�e��
���ڵ�e��![]() ʱ�̣���
ʱ�̣���![]()
D.�����������䣬![]() �·�Ӧ��
�·�Ӧ��![]() ʱ�̴ﵽƽ�⣬���ʱn(H2)����ͼ��d���ֵ��
ʱ�̴ﵽƽ�⣬���ʱn(H2)����ͼ��d���ֵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£������ܱ������з���N2(g)+3H2(g)![]() 2NH3(g)��Ӧ����Ӧ�����뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ��������ƽ��״̬�¸��������ıȽϴ�����ǣ� ��
2NH3(g)��Ӧ����Ӧ�����뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ��������ƽ��״̬�¸��������ıȽϴ�����ǣ� ��
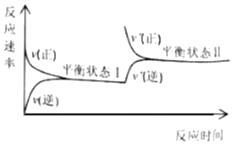
A.ƽ��״̬��ʱ��c(H2)һ��СB.ƽ��״̬��ʱ��c(NH3)һ����
C.ƽ�ⳣ��Kһ����D.ƽ��״̬��ʱ��v(��)һ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com